
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,注意同系物中的“结构相似”是指物质种类相同,若含有官能团,官能团的种类与数目相同;
同分异构体是指分子式相同,但结构不同的化合物,据此进行判断.
解答 解:同系物之间必须具有相似结构,分子间相差1个或若干个CH2原子团,满足条件的为:②CH3CH=CH2、⑤C2H4;
互为同分异构体的化合物必须具有相同分子式、不同结构,满足条件的为:③CH3CH2C≡CH、④CH3C≡CCH3,
故答案为:②;⑤;③;④.
点评 本题考查了同系物、同分异构体的判断,题目难度不大,明确同系物、同分异构体的概念即可解答,注意掌握同系物、同分异构体、同素异形体、同位素之间的区别及判断方法.


科目:高中化学 来源: 题型:解答题
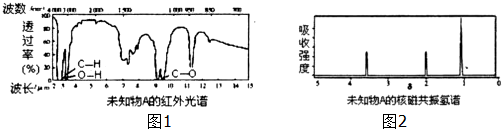
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)
,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
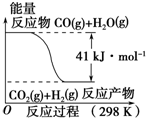
| A. | 该反应为吸热反应 | |
| B. | CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 萃取操作时,应选择有机萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因之一是增加了单位体积内活化分子的百分数 | |
| D. | 有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com