
����Ŀ�����෨����ʶ���о���ѧ���ʳ��÷�����
��.�����������У���ˮ�� ���ռ� ���ۻ���KCl ���Ȼ��ƾ��� ������ ��̼�����ƹ��� ������ ������ ��Һ̬�Ȼ��� ������������Һ
��1���ܵ������_________�����ڵ���ʵ���__________�����ڷǵ���ʵ���________���������ڿո��У�
��2��д�����ʢ�����ˮ�ĵ��뷽��ʽ��____________________________��
��3�������ʢ����Ƴ���Һ����μ������Һ����������÷�Ӧ�����ӷ���ʽ��______________��
���������ʴ�������ת����ϵ��
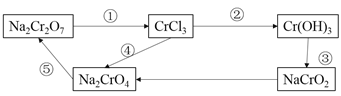
��1���������б�ŵIJ����У����û�ԭ������_____�����ţ���ͬ������������������___��
��2����ת����ϵ��֪Cr(OH)3Ϊ���������������д������KOH��Ӧ�����ӷ���ʽ��___________________________________________________________________________________________________________
���𰸡� �٢ۢݢ� �ڢۢܢޢ� �� NaHCO3=Na++HCO3- HCO3-+OH-+Ba2+=BaCO3��H2O �� �� Cr(OH)3+OH-=CrO2-+2H2O
����������.��1��ˮ���д��������ƶ��ĵ��ӣ��ܵ��磬�ۻ���KCl�����������������Һ�д��������ƶ������ӣ��ܵ��磬�� �٢ۢݢ��ܵ��磻�ռ�ۻ���KCl���Ȼ��ƾ��塢̼�����ƹ�����Һ̬�Ȼ�������ˮ��Һ�л��ۻ�״̬���ܵ���Ļ������ڢۢܢޢ����ڵ���ʣ�������ˮ��Һ�к��ۻ�״̬���ܲ��ܵ���Ļ���������ڷǵ���ʣ��������ڷǵ���ʣ���2�����ʢ�NaHCO3����ˮ�ĵ��뷽��ʽ��NaHCO3=Na++HCO3- ����3�������ʢ�NaHCO3���Ƴ���Һ����μ������Һ����������÷�Ӧ�����ӷ���ʽ��HCO3-+OH-+Ba2+=BaCO3��+H2O
����1���ڷ�Ӧ�У�����CrԪ�ػ��ϼ۽��ͣ�Ӧ���뻹ԭ�����ڢ�CrԪ�ػ��ϼ۲��䣬��CrԪ�ػ��ϼ����ߣ����������������Ԫ�ػ��ϼ۲��䣬���û�ԭ�����Ǣ٣��������������Ǣܡ���2��Cr(OH)3Ϊ�����������������ǿ�ᷴӦ������ǿ�Ӧ������KOH��Ӧ����CrO2-�Σ����ӷ���ʽ��Cr(OH)3+OH-=CrO2-+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲�����ʵ��װ��ͼ���Իش��������⣺
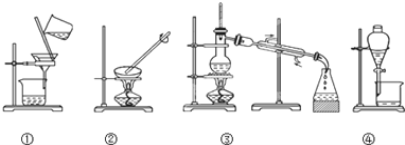
��1��д��ͼ������ʵ����������������� ______ �� ______ �� ______ �� ______ ��
��2��д��װ�â������ò������������� ______ �� ______ ��
��3������ʵ����Ҫ������װ���н��У�����ţ���
a���Ӻ�ˮ����ȡ����ˮ�� ______ �� b�������Ȼ��ƺ�ˮ�� ______ ��
c������̼��ƺ�ˮ�� ______ �� d������ֲ���ͺ�ˮ�� ______ ��
��4��װ�â��в�������������__________________________________��
��5��װ�� ������ȴˮ�ͽ��߳���ԭ����_________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ���ۻ�����һ���������Ӽ�
B. ���ӻ�����һ���������ۼ�
C. ��̬���ʵķ�����һ�����ڹ��ۼ�
D. ȫ���ɷǽ���Ԫ���γɵĻ�����һ���������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ����������������ȷ����( ).
A. ���ӻ�������ܺ����ۼ�B. ���ۻ�������ܺ����Ӽ�
C. ���ӻ�������ֻ�����Ӽ�D. ���ӻ����ﲻ�ܺ����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ����ֱ�۵ط�ӳ�й��������ı仯�����ɣ����и�ͼ��������������ǣ� ��
A. ��ͼ��ʾSO2������Ӧ�ֱ����С�����������·�Ӧ�����е������仯
��ͼ��ʾSO2������Ӧ�ֱ����С�����������·�Ӧ�����е������仯
B.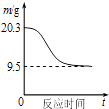 ��ͼ��ʾ0.1molMgCl26H2O�ڿ����г�ּ���ʱ����������ʱ��ı仯
��ͼ��ʾ0.1molMgCl26H2O�ڿ����г�ּ���ʱ����������ʱ��ı仯
C.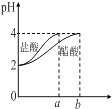 ��ͼ��ʾ�ֱ�ϡ��1mLpH=2������ʹ���ʱ��ҺpH�ı仯��ͼ��b��100mL
��ͼ��ʾ�ֱ�ϡ��1mLpH=2������ʹ���ʱ��ҺpH�ı仯��ͼ��b��100mL
D.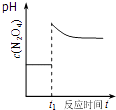 ��ͼ��ʾƽ��2NO2��g��N2O4��g����t1ʱѸ�ٽ������С��c��N2O4���ı仯
��ͼ��ʾƽ��2NO2��g��N2O4��g����t1ʱѸ�ٽ������С��c��N2O4���ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.1mol Na2CO3�����������õ�һ�����Ϊ1L����Һ����Һ�в�������pH �Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ���ǣ� �� 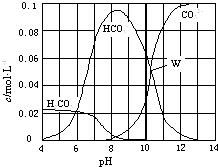
A.W����ʾ����Һ�У�c��CO32����=c��HCO3������c��OH������c��H+��
B.pH=4����Һ�У�c��H2CO3��+c��HCO3����+c��CO32����=0.1molL��1
C.pH=8����Һ�У�c��Na+����c��HCO3������c��H2CO3����c��CO32����
D.pH=11����Һ�У�c��Na+��+c ��H+��=c��OH����+c��Cl����+c��CO32����+c��HCO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�о����֣����ֽ��������ֽ�������������塣ij������ƷM����������ͭ�����е����ֻ�������ɡ�
��ʵ��Ŀ�ġ�̽�� ________________ ��
��������衿����1��M�ijɷ�������ͭ��
����2��M�ijɷ�����������
����3��M�ijɷ���______��
����4��M�ijɷ�������ͭ����
�����ʵ�顿ȡ����������Ϊm g��M��Ʒ����ͼ1��ͼ2װ�÷ֱ����ʵ�飺ʵ��ǰ���������dz��¡���ѹ������ƷM��ַ�Ӧ��ͼ1��ͼ2ʵ�鷽�����ʵ�鲢�����������ֱ�ΪV1 L��V2 L�����ⶨ������������ۺϳɱ�״������
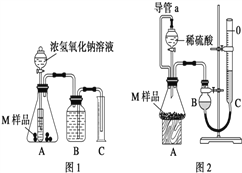
��1�����ʵ��Ŀ�ĺͲ���������ݡ�
��2������ʵ����Ҫ0.50mol/LNaOH��Һ 180mL������ѧ���ù����������ʱӦ����____g NaOH����������ƽ������������NaOH�����л���Na2O���ʻᵼ��������ҺŨ��_____������ƫ��������ƫС��������Ӱ������
��3������ʵ��1ǰ��Bƿ�е�ˮû��װ����ʹ��õ�������� _______������ƫ��������ƫС��������Ӱ��������ʵ��2�еĵ���a������Ϊ_____________���ܷ�ֹ�����Һ����ų���ƿ�ڲ��ֿ��������²ⶨ���������ƫ��
��4����V1��0�����Ʋ��������� ________������1������2������3������4����һ����������������3��������V1 ________V2������������������������������
��5����V1��V2��0 ����M��Ʒ����������Ϊ____________g���ú�V1��V2ʽ�ӱ�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D����Ԫ�أ����ǵ�ԭ����������������С��18��A��B��ͬһ���ڣ�Aԭ�ӵĵ���ʽΪ ![]() ��Bԭ��L��ĵ���������K���3����0.1mol C�����ܴ������û���2.24L��������״������ͬʱ���ĵ��Ӳ�ṹ�������ԭ�ӵĵ��Ӳ�ṹ��ͬ��D���ӵİ뾶��C���ӵ�С��D������B���ӵĵ��Ӳ�ṹ��ͬ��
��Bԭ��L��ĵ���������K���3����0.1mol C�����ܴ������û���2.24L��������״������ͬʱ���ĵ��Ӳ�ṹ�������ԭ�ӵĵ��Ӳ�ṹ��ͬ��D���ӵİ뾶��C���ӵ�С��D������B���ӵĵ��Ӳ�ṹ��ͬ��
��1��Ԫ��A��B��C��D�ֱ��ǣ�A �� B �� C �� D ��
��2��DԪ�������ڱ������������壮
��3���õ���ʽ��ʾA����̬�⻯����γɹ��̣� ��
��4��A��B�ĵ��ʳ�ַ�Ӧ���ɻ�����ĵ���ʽ�� ��
��5��B��C�γɵĻ����������ӻ����ﻹ�ǹ��ۻ�������֤���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ﮩ�������ͭ��������Ļ���������Cu4O��PO4��2 �� ��ͨ�����з�Ӧ�Ʊ��� 2Na3PO4+4CuSO4+2NH3H2O=Cu4O��PO4��2��+3Na2SO4+��NH4��2SO4+H2O
��ش��������⣺
��1��д����̬Cu2+����Χ�����Ų�ʽ�� �� C��N��O����Ԫ�صĵ�һ��������С�����˳��Ϊ����Ԫ�ط��ű�ʾ����
��2��PO43���Ŀռ乹���� ��
��3���Ƚ�CuSO4������ɱ��۵���Ըߵͣ�������ԭ�� ��
��4����������ͭ�ķ��ӽṹ��ͼ������̼ԭ�ӵ��ӻ���ʽΪ ��
��5��������ͭ��Һ�м��������ˮ����������������İ���ͭ����д���İ���ͭ���ӵĽṹʽ ��
��6������ͭ����Ҫ�Ľ�����Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ������������������[Fe��CN��6]4���в����� ��
A.���ۼ�
B.�Ǽ��Լ�
C.���
D.�Ҽ�
E.�м�
��7��NaCl��������r��Na+��=a pm��r��Cl����=b pm����NaCl�����Ŀռ�������Ϊ �� ���������������ܶѻ���ʽ���ڣ��ú���a��b����ʽ��ʾ�� 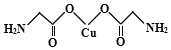
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com