
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.01molL-1KAl(SO4)2溶液中的SO42-数目为0.02NA
B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA
D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
【答案】C
【解析】
A.体积未知,当溶液体积为1L时,0.01mol·L-1KAl(SO4)2溶液中,硫酸根离子数为0.02NA,故A错误;
B.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,当生成1mol氯气,转移的电子数为2NA,KClO3+6 HCl(浓)=KCl+3 Cl2↑+3 H2O,当生成1mol氯气,转移的电子数为
MnCl2+Cl2↑+2H2O,当生成1mol氯气,转移的电子数为2NA,KClO3+6 HCl(浓)=KCl+3 Cl2↑+3 H2O,当生成1mol氯气,转移的电子数为![]() NA,故B错误;
NA,故B错误;
C.将1molNH4NO3溶于稀氨水中,根据电荷守恒可知有:n(OH-)+n(NO3-)=n(H+)+n(NH4+),而溶液呈中性,则有n(OH-)=n(H+),故可知n(NH4+)=n(NO3-)=1mol,即铵根离子个数为NA个,故C正确;
D.葡萄糖分子式C6H12O6、蔗糖分子式C12H22O11,两种分子中碳、氢、氧三种元素的原子个数比分别为:1:2:1、12:22:11,含碳量不同,故混合物中的碳的质量无法确定,碳原子的数目无法确定,故D错误;
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】根据氧化还原反应CuSO4+Zn=ZnSO4+Cu,可设计如下原电池装置:

⑴该原电池电解质溶液中的溶质是_______。
⑵电极A可选用:____,该电极的反应现象是:_____。
⑶电极B只能用:____,该电极的反应现象是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究甲醛与新制的Cu(OH)2的反应:
(1)向6 mL 6 mol·L1 NaOH溶液中滴加8滴2%CuSO4溶液,振荡,加入0.5 mL15%甲醛溶液,混合均匀,水浴加热,迅速产生红色沉淀,其周围剧烈产生无色气体。
(2)反应停止后分离出沉淀,将所得沉淀洗净后加入浓盐酸,不溶解。
(3)相同条件下,甲酸钠溶液与新制的Cu(OH)2反应,未观察到明显现象。
已知:Cu2O![]() [CuCl2],甲醛是具有强还原性的气体。
[CuCl2],甲醛是具有强还原性的气体。
下列说法正确的是
A.红色沉淀的主要成分不是Cu2O,可能是Cu
B.将产生的无色气体通过灼热的CuO后得到红色固体,气体中一定含有CO
C.从甲醛的结构 ![]() 推测,其氧化产物可能为碳酸(
推测,其氧化产物可能为碳酸(![]() ),因此实验中得到的无色气体是CO2
),因此实验中得到的无色气体是CO2
D.含有-CHO的有机物都可以被新制Cu(OH)2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是( )
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含的质子数由多到少是:CO2>SO2>CH4>O2>H2
C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法不正确的是
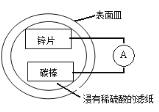
A.锌片作负极
B.碳棒上有气泡产生
C.电子由锌片经导线流向碳棒
D.可将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“锌”和“碳棒”作为导电材料,根据氧化还原反应H2SO4+Zn=ZnSO4+H2↑,设计如下原电池装置:
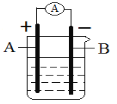
⑴该原电池电解质溶液中的溶质是________。
⑵电极A是________,该电极反应现象为_______。
⑶电极B是______,该电极反应现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《神农本草经》记载,神农尝百草,日遇七十二毒,得茶而解。茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
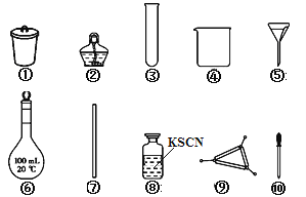
A. 将茶叶灼烧灰化,选用①、②和⑨
B. 用浓盐酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C. 过滤得到滤液,选用④、⑤和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有42.4g由Fe、Al、Al2O3组成的混合物,将固体混合物分成两等份,将其中一份加入足量的NaOH溶液中充分反应后剩余固体质量为5.6g;将另一份完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96 L,欲使该反应后溶液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A. 300mL B. 600mL C. 800mL D. 900mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究新的热点。 完成下列问题:
(1)CO2催化加氢合成CH3OCH3是一种CO2转化方法,其过程中主要发生下列反应:
反应I:![]()
反应Ⅱ:![]()
①写出CO和H2合成CH3OCH3的热化学方程式____。
②分别在2L恒温密闭容器甲(恒温恒容)、乙(恒温恒压)中,加入CO2和H2各1 mol的混合气体,假设只发生反应Ⅱ,则两容器中反应达平衡后放出或吸收的热量较多的是____(填“甲”或“乙”)。当反应5 min时,测得甲容器中压强变为原来的一半,则用CO2表示的反应的速率= ___。
③在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
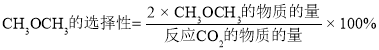
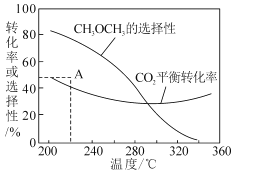
i)温度高于300℃,温度对CO2平衡转化率影响较大的是反应____(填“I”或“Ⅱ”)。
ii)220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施可以是____(任答一条)。
(2)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为____(写离子符号);若所得溶液c(HCO3-):c(CO32-)=1:5,溶液pH= ___。(室温下,H2CO3的![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com