
【题目】为研究A的组成与结构,某同学进行了如下实验:
实 验 步 骤 | 实 验 结 论 |
(i)将9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4g和13.2g. | (i)A的实验式为 . |
(ii)通过质谱法测得其相对分子质量为90. | (ii)A的分子式为 |
(iii)另取9.0g A,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (iii)A中含有的官能团名称为 . |
(iv)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2:2:1:1. | (iv)综上所述,A的结构简式为 . |
【答案】CH2O;C3H6O3;羧基、羟基;![]() ;
;![]()
【解析】解:(i)浓硫酸增重5.4g,则生成水的质量是5.4g,生成n(H2O)= ![]() =0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)=
=0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)= ![]() =0.3mol,所以n(C)=0.3mol,9gA中n(O)=
=0.3mol,所以n(C)=0.3mol,9gA中n(O)= ![]() =0.3mol,则n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,则有机物A的实验式为:CH2O,
=0.3mol,则n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,则有机物A的实验式为:CH2O,
所以答案是:CH2O;
(ii)有机物A的实验式为CH2O,设其分子式为(CH2O)x,相对分子质量为90,则30x=90,故x=3,则A的分子式为:C3H6O3 ,
所以答案是:C3H6O3;
(iii)9.0gA的物质的量= ![]() =0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)=
=0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)= ![]() =0.1mol,所以含有一个﹣COOH;
=0.1mol,所以含有一个﹣COOH;
醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),n(H2)= ![]() =0.1mol,反应中羧基或羟基的物质的量与氢气的物质的量之比为2:1,而A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个﹣COOH外还含有一个﹣OH,
=0.1mol,反应中羧基或羟基的物质的量与氢气的物质的量之比为2:1,而A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个﹣COOH外还含有一个﹣OH,
所以答案是:羧基、羟基;
(iv)A的核磁共振氢谱图有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是2:2:1:1,所以结构简式为: ![]() ,
,
(v)与NaHCO3反应的化学方程式为: ![]() ,
,
所以答案是: ![]() ;
; ![]() .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 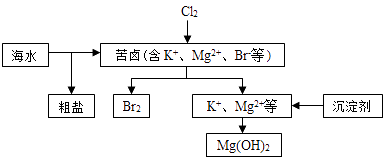
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式正确的是( )
A.25℃,0.1mol/L pH=4.5 的NaHC2O4溶液 c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(H2C2O4)
)>c(H2C2O4)
B.向0.2mol/L的NaHCO3溶液中加入等体积的0.1mol/L的NaOH溶液c(H+)+c(Na+)=c(OH﹣)+c(CO ![]() )+c(HCO3﹣)
)+c(HCO3﹣)
C.常温下,氯化铵和氨水的混合溶液其pH=7,c(Cl﹣)=0.1mol/L c(Cl﹣)>c(NH4+)>c(OH﹣)=c(H+)
D.浓度均为0.1mol/L的醋酸钠和醋酸的混合溶液中c(CH3COO﹣)﹣c(CH3COOH)=2[c(H+)﹣c(OH﹣)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+ . 现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( ) 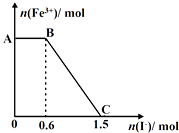
A.开始加入的K2Cr2O7为0.45mol
B.图中AB段的氧化剂为K2Cr2O7
C.图中BC段发生的反应为Fe3++2I﹣→Fe2++I2
D.K2Cr2O7可与FeSO4反应的物质的量为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应,下列 叙述错误的是
A. 反应过程中能量关系可用下图表示
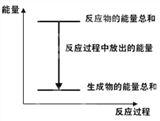
B. 若将该反应设计成原电池则锌为负极
C. ΔH 的值与反应方程式的化学计量数有关
D. 若将其设计为原电池,当有 32.5g 锌溶解时,正极放出气体一定为 11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:已知:①SO2(g)+Cl2(g)SO2Cl2(l)+Q(Q>0)
②硫酰氯常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气.
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是 .
(2)装置C中干燥管里碱石灰作用是 . 装置E为储气装置,用于提供氯气,当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率为 . 为提高硫酰氯的产率,本实验操作中还需要注意的事项有
(3)反应结束后,将C装置中三颈烧瓶里的混合物分开的实验操作是 , 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式
(4)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.9g金属锡(Sn)跟100mL 12molL﹣1 HNO3共热一段时间.完全反应后测定溶液中c(H+)为8molL﹣1 , 溶液体积仍为100mL.产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol.由此推断氧化产物可能是( )
A.SnO24H2O
B.Sn(NO3)4
C.Sn(NO3)2
D.Sn(NO3)2和Sn(NO3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com