
 (I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
(I)CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是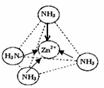 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| B、三氯化铁溶液中通入硫化氢气体:2Fe3++3H2S═Fe2S3↓+6H+ |
| C、用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-═Ag++NO2↑+H2O |
| D、4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为5NA |
| B、标准状况下,5.6L氧气中含有O的总数为0.5NA |
| C、25℃时,pH=13的Ba(OH)2溶液1.0L中含有OH-总数为0.1NA |
| D、20g重水(D2O)中所含电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
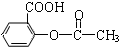 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |


查看答案和解析>>
科目:高中化学 来源: 题型:

2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳与浓硝酸 |
| B、铜与浓硫酸 |
| C、锌与稀硫酸 |
| D、二氧化锰与浓盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com