
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1)![]() 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁![]() Ⅲ
Ⅲ![]() ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中![]() 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___![]() 碳原子为____杂化,
碳原子为____杂化,![]() 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中![]() 键
键![]() 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇![]() 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇![]() 属于____晶体.
属于____晶体.![]() 存在的化学键有_____
存在的化学键有_____![]() 填字母
填字母![]() .
.
A.离子键 ![]() 极性键
极性键 ![]() 非极性键
非极性键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 金属键
金属键
(4)已知: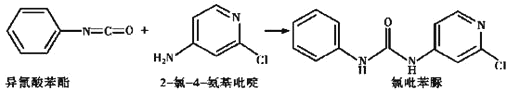 ,反应后,
,反应后,![]() 键_____,
键_____,![]() 键_____
键_____![]() 填“增加”或“减少”
填“增加”或“减少”![]() .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”,可表示成
键”,可表示成![]() ,则
,则![]()
![]() 咪唑
咪唑![]() 中的“离域
中的“离域![]() 键”可表示为_________
键”可表示为_________
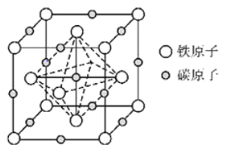
(6)奥氏体是碳溶解在![]() 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为![]() ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() .
.
【答案】![]() 或
或![]()
![]()
![]() 杂化 平面三角形
杂化 平面三角形 ![]() 分子 ABD 减少 减少
分子 ABD 减少 减少 ![]()
【解析】
(1)Fe是26号元素,原子核外电子排布式为s22s23p63s23p63d64s2,失去4s能级2个电子,再失去3d能级1个电子形成Fe3+;同周期主族元素自左而右电负性增大,C、N、O在它们的氢化物中均表现负价,说明它们对键合电子比H元素的强;C原子形成2个C-N键、1个C=O双键,没有孤对电子,杂化轨道数目为3;NO3-中N原子孤电子对数=![]() =0、价层电子对数=0+3=3;
=0、价层电子对数=0+3=3;
(2)CO(NH2)2分子中含有1个![]() 键、2个
键、2个![]() 键、4个
键、4个![]() 键,单键为
键,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,分子中有7个
键,分子中有7个![]() 键、1个
键、1个![]() 键;
键;
(3)铝原子簇A113的性质与卤素相似,说明原子簇A113属于分子晶体。Na+、[Al(OH)4]- 之间形成离子键,[Al(OH)4]-中Al3+与OH-之间存在配位键,O原子与H原子之间形成极性键;
(4)反应发生加成反应,生成物与反应物相比σ键增加了1个,而π键减少1个;
(5)环上原子处于同一平面,碳原子及形成碳碳双键的N原子采取sp2杂化,均有1个单电子处于平行的p轨道内,形成单键的N原子有1对孤对电子,“离域π键”为5原子、6电子形成大派键;
(5)Fe原子处于顶点、面心,碳原子处于体心、棱中心,均摊法计算Fe、C原子数目,计算晶胞中原子总质量,晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离,结合晶胞中原子总质量=晶胞体积×晶体密度计算。
![]() 原子核外有26个电子,核外电子排布为
原子核外有26个电子,核外电子排布为![]() ,Fe原子失去4s能级2个电子、3d能级1个电子形成
,Fe原子失去4s能级2个电子、3d能级1个电子形成![]() ,Fe
,Fe![]() 电子排布式为
电子排布式为![]() 或
或![]() ;
;![]() 中所含非金属元素为H、C、N、O,通常元素的非金属性越强,电负性越大,则所含非金属元素C、N、O、H中O的非金属性最强,H最弱,四者的电负性由大到小的顺序是O、N、C、H;碳原子形成以碳氧双键和两个碳氮单键,无孤电子对,则其杂化类型为
中所含非金属元素为H、C、N、O,通常元素的非金属性越强,电负性越大,则所含非金属元素C、N、O、H中O的非金属性最强,H最弱,四者的电负性由大到小的顺序是O、N、C、H;碳原子形成以碳氧双键和两个碳氮单键,无孤电子对,则其杂化类型为![]() 杂化;
杂化;![]() 中价层电子对个数为3且不含孤电子对,所以为平面三角形;
中价层电子对个数为3且不含孤电子对,所以为平面三角形;
![]() 分子中含有1个
分子中含有1个![]() 键、2个
键、2个![]() 键、4个
键、4个![]() 键,单键为
键,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,分子中有7个
键,分子中有7个![]() 键、1个
键、1个![]() 键,
键,![]() 分子中含有的
分子中含有的![]() 键与
键与![]() 键的数目之比为7:1;
键的数目之比为7:1;
![]() 卤素单质属于分子晶体,铝原子簇
卤素单质属于分子晶体,铝原子簇![]() 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇![]() 也属于分子晶体。
也属于分子晶体。![]() 属于离化合物,存在着离子键,铝是缺电子结构,能接受氢氧根离子给与的孤对电子形成配位键,氧氢之间可以形成极性键。所以
属于离化合物,存在着离子键,铝是缺电子结构,能接受氢氧根离子给与的孤对电子形成配位键,氧氢之间可以形成极性键。所以![]() 属于离化合物中含有离子键、极性键、配位键;
属于离化合物中含有离子键、极性键、配位键;
![]() 每生成1mol氯吡苯脲,需要
每生成1mol氯吡苯脲,需要![]() 氯
氯![]() 氨基吡啶、1mol异氰酸苯酯,反应过程中每个
氨基吡啶、1mol异氰酸苯酯,反应过程中每个![]() 氯
氯![]() 氨基吡啶分子断裂一个
氨基吡啶分子断裂一个![]() 键、每个异氰酸苯酯分子断裂一个
键、每个异氰酸苯酯分子断裂一个![]() 键,所以当
键,所以当![]() 键减少,
键减少,![]() 键也减少;
键也减少;
![]() 多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”。因为
键”。因为![]()
![]() 咪唑
咪唑![]() 中的有5个原子参与形成
中的有5个原子参与形成![]() 键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为
键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为![]() ;
;
![]() 晶胞结构分析可知一个晶胞中含铁原子
晶胞结构分析可知一个晶胞中含铁原子![]() ,碳原子
,碳原子![]() ,化学式中铁原子和碳原子比为1:1,化学式为FeC;晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则
,化学式中铁原子和碳原子比为1:1,化学式为FeC;晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则![]() ,
,![]() ,密度
,密度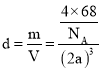 ,解得
,解得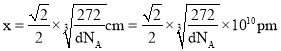 。
。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
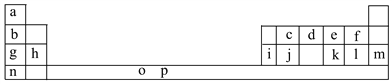
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
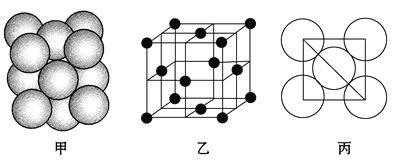
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Ni3+的价电子排布式为________;银与铜位于同一族,银元素位于元素周期表的________区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体结构如图1所示:
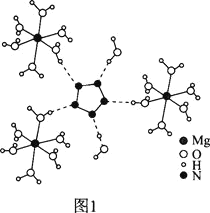
![]() 、O、Mg元素的前3级电离能如下表所示:
、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
X、Y、Z中为N元素的是________,判断理由是________。
②从作用力类型看,Mg2+与H2O之间是________、N5-与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是________。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则N4-中的大
,则N4-中的大![]() 键应表示为________。
键应表示为________。
(3)AgN5的立方晶胞结构如图2所示:
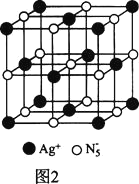
Ag+周围距离最近的Ag+有________个。若晶体中紧邻的N5-与Ag+的平均距离为anm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为________gcm-3用含a、NA的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林口服时,具有解热镇痛作用。是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄。近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成。它的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
【反应原理及部分装置】

【实验流程】

已知:①醋酸酐遇水分解生成醋酸。
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,副产物为高分子化合物,难溶于水。
回答下列问题:
(1)合成过程中要控制温度在85℃~90℃,最合适的加热方法 。
(2)用图1装置过滤比普通漏斗过滤的优点是 。
(3)粗产品提纯:
①分批用少量饱和NaHCO3溶液溶解粗产品,目的是 ;判断该过程结束的现象是 。
②加浓盐酸、冷却后的操作是__________、______、干燥、称重、计算产率。
③纯度检验:取少许产品加入盛有2 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。可能的原因是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品mg;
Ⅱ.将样品研碎,溶于V1 mL a mol/LNaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2 mL。
已知:乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:

则阿司匹林药片中乙酰水杨酸质量分数的表达式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外化学兴趣小组欲从铝土矿中提取少量的Al2O3,查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
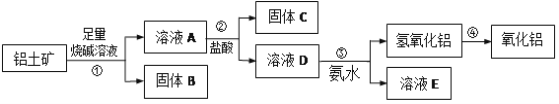
(1)固体B的主要用途为(只写一种即可)______;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应。发生反应的离子方程式是:______
(3)第③步的实验操作名称是______,请简述洗涤的操作过程______。若往A溶液中通入足量CO2,产生的沉淀为______(填化学式);
(4)工业上制取AlCl3常用Al2O3与炭、Cl2在高温条件下反应,已知每消耗0.5mol炭单质,转移1mol电子,则该反应的化学方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的N2和H2,在相同温度下发生合成氨反应,并达到平衡。在这过程中,甲容器为恒容容器,乙容器为恒压容器,若甲容器中H2的转化率为a%,则乙容器中H2的转化率为:
A.等于a%B.大于a%C.小于a%D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,发生反应3A(g)+2B(g)![]() 4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.若向平衡体系移走部分D,则此时正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
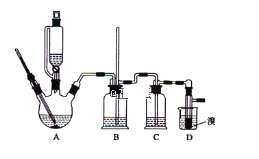
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com