
【题目】镧系金属元素铈(Ce)常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题:
(1)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成NO2-、NO3- 物质的量之比为1:1,试写出该反应的离子方程式:______________________。
(2)用电解的方法可将上述吸收液中的NO2- 转化为稳定的无毒气体,同时生成Ce4+,其原理如下图所示。

①无毒气体从电解槽的_______(填字母代号)口逸出。
②每生成1mol无毒气体,同时可再生Ce4+ ______mol
(3)铈元素在自然界中主要以氟碳铈矿的形式存在,其主要化学成分为 CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下图所示
![]()

①焙烧过程中发生的主要反应的氧化剂和还原剂的物质的量之比为__________。
②向Ce(BF4)3中加入KCl溶液的目的是_________________________________。
③加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是_________________________________________________________________。
【答案】4Ce4++2NO+3H2O=4Ce3++NO![]() +NO
+NO![]() +6H+ c 6 1:4 避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) NH4Cl固体分解产生的HCl可抑制CeCl3的水解
+6H+ c 6 1:4 避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) NH4Cl固体分解产生的HCl可抑制CeCl3的水解
【解析】
(1)NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-,反应过程中N化合价升高,Ce化合价则降低,氧化剂为Ce4+,还原剂为NO;
(2)①采用电解法将NO2-转化为无毒物质,同时再生Ce4+,过程中Ce化合价升高,为失电子反应,电解池中阳极处的反应为失电子反应;
②电解池阴极发生的反应为物质得到电子,发生还原反应,根据装置图,H+到阴极参加反应,电解将NO2-转化为无毒物质,可判断为N2,据此写出电极反应;
(3)①焙烧过程中,CeFCO3转化生成CeO2和CeF4,焙烧过程O2参加反应,据此写出主要反应的方程式;
②向Ce(BF4)3中加入KCl溶液生成CeCl3和KBF,防止生成Ce(BF4)3沉淀;
③加热CeCl36H2O和NH4Cl的固体混合物可得固体无水CeCl3,考虑到Ce是镧系重金属,重金属离子会水解,NH4Cl的作用是调控溶液为酸性,抑制CeCl3的水解。
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3- 物质的量之比为1:1,,反应的离子方程式为4Ce4++2NO+3H2O=4Ce3++NO2-+NO3-+6H+。
因此,本题正确答案是:4Ce4++2NO+3H2O=4Ce3++NO2-+NO3-+6H+;
(2)①电解池中Ce3+在阳极失去电子转化为Ce4+,因此Ce4+从电解槽的a口流出,阴极是NO2-得到电子转化为N2,则无毒气体从电解槽的c口逸出。
②阳极电极反应式为:Ce3+-e-= Ce4+,阴极电极反应式为:2NO2-+8H++6e-=N2↑+4H2O,每生成1mol无毒气体,同时可再生6mol Ce4+。
因此,本题正确答案是:c ;6;
(3)①根据流程图可知焙烧过程中CeFCO3与氧气反应生成CeO2、CeF4和CO2,反应方程式为4CeFCO3+O2![]() 3CeO2+ CeF4+4CO2,其中氧化剂O2和还原剂CeFCO3的物质的量之比为1:4。
3CeO2+ CeF4+4CO2,其中氧化剂O2和还原剂CeFCO3的物质的量之比为1:4。
②避免Ce3+以Ce(BF4)3形式沉淀而损失或将Ce3+全部转化为CeCl3,提高产率,故向Ce(BF4)3中加入KCl溶液。
③加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是NH4Cl固体分解产生的HCl可抑制CeCl3的水解。
因此,本题正确答案是:1:4;避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) ;NH4Cl固体分解产生的HCl可抑制CeCl3的水解。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】分类是学习化学的一种重要方法,以下分类不正确的是( )
A.常见的黑色固体:氧化铜、四氧化三铁
B.常见的由原子构成的物质:铜、金刚石
C.常见的含有氧分子的物质:空气、二氧化碳
D.常见的氧化物:氧化铜、氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=a,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为__________________(填化学式)而除去。
(2)①中加入的试剂应该选择__________为宜,其原因是______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为____________________________________。
(4)已知Fe(OH)3的Ksp=1×10-35 ;化学上通常认为残留在溶液中离子浓度小等于1×10-5mol/L时,沉淀完全。方案③中a最小值为________________。
(5)下列与方案③相关的叙述中,正确的是___________________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=a可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=a的溶液中
E.在pH>a的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能比较氮和氧非金属性相对强弱的是
A.氨气在氧气中燃烧生成氮气B.沸点:H2O>NH3
C.NO中N为+2价,氧为-2价D.热稳定性:H2O>NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.带相反电荷离子之间的相互作用称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属元素原子间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是( )

A. 第8min末 A的反应速率为0.08mol·L-1·min-1
B. 在0-54分钟的反应过程中该可逆反应的平衡常数始终为4
C. 30min时改变的条件是减小压强,40min时改变的条件是降低温度
D. 反应方程式中的x=1,且正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按C、N、O、F的顺序,下列递变规律正确的是( )
A.原子半径逐渐增大
B.元素原子得电子能力逐渐减弱
C.气态氢化物稳定性逐渐增强
D.最高化合价逐渐增高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A、B中均充入1mol X、l mol Y,起始时A、B的体积都等于1L。在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g)。下列说法正确的是
2Z(g)+W(g)。下列说法正确的是

A. 两容器中的反应分别达到平衡时,反应物X的速率:v(B)>v(A)
B. 平衡时X的转化率: A<B
C. 平衡时的压强:PA>PB
D. 平衡时Y体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸利多卡因(F)可用于急性心肌梗塞后室性早搏和室性心动过速,合成路线如下:
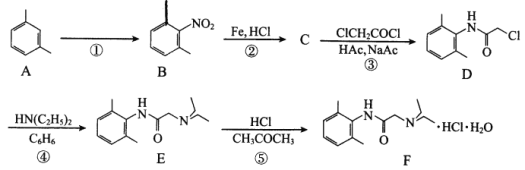
回答下列问题:
(1)A的化学名称为_________。
(2)反应①所需试剂、条件分别为_________、_________。
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有_________种(不考虑立体异构)、其中官能团的名称是_________。
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸氢钠溶液反应可放出CO2气体。
(4)C的结构简式为_________。
(5)在反应①~⑤中属于取代反应的有_________。
(6)ClCH2COCl与足量NaOH溶液共热充分反应的化学方程式为_________。
(7)NH(C2H5)2在核磁共振氢谱上有_________组峰,峰面积比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com