
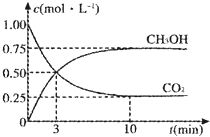
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.| 光合作用 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| △c |
| △t |
| 2.25mol/L |
| 10min |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |
| Ksp(CaCO3) | ||
c(C
|
| 2.8×10-9 |
| 2×10-4 |


科目:高中化学 来源: 题型:
| A、化学反应热效应数值与参加反应的物质多少有关 |
| B、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 |
| C、需要加热才能进行的化学反应不一定是吸热反应 |
| D、放热反应不需加热即可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
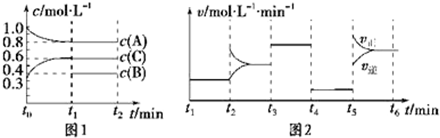
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
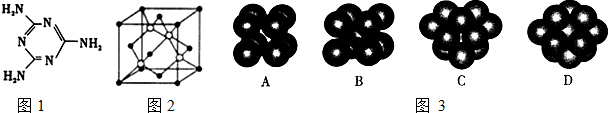
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.25 | B、2 | C、4 | D、16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行元素分析,测得粉末中K和S两种元素的质量比为39:16,则该粉末没有变质 |
| B、将粉末溶于水,加入氯化钡,有白色沉淀生成,则该粉末变质了 |
| C、将粉末加入盐酸中,产生气泡,则该粉末没有变质 |
| D、将粉末溶于水,滴加过量的盐酸,有气泡产生,再加入氯化钡溶液,有白色沉淀生成,则该粉末部分变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com