
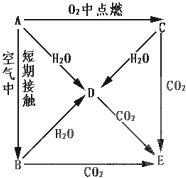
 A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.

科目:高中化学 来源: 题型:
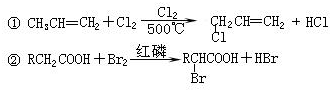
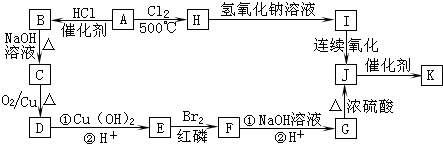
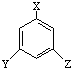 ,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有
,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到的是蓝色沉淀 | ||
B、该溶液中c(S
| ||
| C、向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | ||
| D、向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
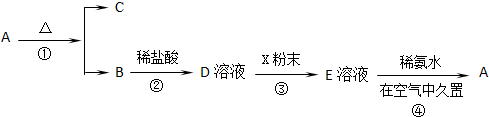
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、450ml,52.65g |
| B、任意规格,52.65g |
| C、500 ml,58.5g |
| D、1000 ml,117g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com