
【题目】能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知反应:
N2(g)+3H2(g)![]() 2NH3(g) △H=-93 kJ/mol。
2NH3(g) △H=-93 kJ/mol。
试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
化学键 | H-H | N-H | N≡N |
键kJ/mol | 436 | a | 945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
②H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)己知:HCN(aq)与NaOH(aq)反应的焓变 △H=-12.1 kJ·mol-1;HCl(aq)与 NaOH(aq)反应的焓变△H=-55.6 kJ·mol-1。则HCN在水溶液中电离的焓变△H等于 。
(4) 己知:H2(g)+1/2O2(g)=H2O(I) △H =-285.83 kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H =-282.9 kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(I),并放出114.3kJ热量,则混合气体中CO的物质的量为 (计算结果保留一位小数)。
【答案】(1)391(3分)
(2)2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(I) ΔH =(a+4b) kJ/mol (3分)
(3)+43.5kJ·mol-1 (3 分) (4)0.lmol (3分)
【解析】
试题分析:(1)N2(g)+3H2(g)2NH3(g)△H=-93kJmol-1,化学反应的焓变=反应物键能总和-生成物键能总和,所以得到-93KJ/mol=945KJ/mol+3×436KJ/mol-6×a,计算得到a=391KJ/mol;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=a kJ/mol
②H2O(g)=H2O(l) △H=b kJ/mol
①+②×4得到液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b) kJ/mol;
(3)反应的热化学方程式分别为:
HCN(aq)+OH-(aq)═CN-(aq)+H2O(l)△H=-12.1kJmol-1…①
H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJmol-1…②
用①-②可得HCN电离的热化学方程式为:HCN(aq)H+(aq)+CN-(aq)△H=-12.1kJmol-1-(-55.6kJmol-1)=+43.5kJmol-1;
(4)水的物质的量为:5.4g÷18g/mol=0.3mol,
由2H2+O2═2H2O可知,n(H2)=n(H2O)=0.3mol,
由H2(g)+1/2O2(g)═H2O(l)△H=-285.83kJmol-1可知,
0.3molH2燃烧放出的热量为:285.83kJ/mol×0.3mol=85.749kJ,
则CO燃烧放出的热量为:114.03kJ-85.749kJ=28.281kJ,
设混合气体中CO的物质的量为x,则
2CO(g)+O2(g)=2CO2(g)△H=-565.8kJmol-1
2 565.8kJ
x 28.281kJ
则:2:x=565.8kJ:28.281kJ,解得:x=0.1mol,即原混合气体中CO的物质的量为0.1mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:

(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】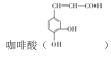 是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:
是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:

已知:
(1)咖啡酸的分子式为_____,含氧官能团有______。
(2)A的结构简式为_____,该分子的核磁共振氢谱峰面积之比为______。
(3)反应④的化学方程式为________,反应类型为_______。
(4)满足下列条件的咖啡酸的同分异构体有_____种。
①苯环上有三个取代基②1mol该物质能与2molNaHCO3反应。
(5)检验F中碳碳双键官能团的方法是_______。
(6)苯丙烯酸的结构简式为![]() ,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的烧碱溶液滴定未知浓度的盐酸,下列操作中正确的是
A. 碱式滴定管用蒸馏水洗净后,直接加入已知浓度的烧碱溶液
B. 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的盐酸
C. 滴定时,没有逐出滴定管下口的气泡
D. 该实验中,某同学将消耗已知浓度的烧碱溶液的体积记录为 22.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明CH4的空间构型是正四面体而不是平面正方形的是
A. 4个H与C的距离相等 B. CH4没有同分异构体
C. CH4分子中的键角相等 D. CH2Cl2没有同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电力工业所需的钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3·H2O及FeO等杂质。回收废酸同时生产含铁产品的流程如下:

已知:i.酸洗钢制构件后得到废酸的主要成分如下表所示。

ii pH <4时,Fe2+不易被氧气氧化。
(1)酸洗钢制构件时发生反应的离子方程式:2H++ FeO=Fe2++H2O、_______________。
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq) ![]() FeSO4(s)+2HCl( aq)。
FeSO4(s)+2HCl( aq)。
①加入过量H2SO4的作用是_____________(至少写出两点)。
②用化学平衡原理解释鼓入空气的目的:_____________。
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是_________________。
(4)过程IV发生反应的离子方程式是____________________。
(5)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X- ![]() RX +OH-。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-
RX +OH-。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4- ![]() Fe3+ +4C1-。
Fe3+ +4C1-。
①吸附后溶液酸性下降的原因是_______________。
②洗脱液中主要含有的溶质是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一恒压密闭容器中充入1 mol N2和3 mol H2,在一定条件下发生反应N2+3H2![]() 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
A. N2完全转化为NH3时,即可视为达到化学平衡状态。
B. 达到化学平衡时,容器内压强和气体密度都不再变化。
C. 达到化学平衡时,反应则停止进行。
D. 达到化学平衡时,3ν(逆NH3)=2ν(正H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某橙汁饮料包装袋上的说明:
品名 | 浓缩橙汁 |
配料 | 水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、山梨酸钾等 |
鲜橙原汁含量 | ≥20% |
净含量 | 1.5L |
生产日期 | 标于瓶盖上 |
(1)配料中属于着色剂的是______________。
(2)该橙汁饮料__________(填“含有”或“不含”)防腐剂。
(3)上述各种配料中,国家对__________、_____________的含量进行严格规定加以控制。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+![]() O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A.当10NA个电子转移时,该反应吸收1300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com