
分析 (1)焊药为氯化铵,由其作用是消除焊接处的铁锈可知反应物,利用元素守恒来分析X;
(2)Fe元素的化合价降低、N元素的化合价升高,利用电子守恒及质量守恒定律来配平反应;
(3)由生成氮气时转移的电子来计算.
解答 解:(1)根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,则该反应得生成物为FeCl3、N2、Fe和X,根据元素守恒可知X中含有H、O元素,则X为H2O,
故答案为:H2O;
(2)由反应物和生成物可知,NH4Cl+Fe2O3→Fe+FeCl3+N2↑+H2O,该反应Fe元素的化合价由+3价降低为0,N元素的化合价由-3价升高到0,
根据电子守恒可知,得电子数=失去电子数=18e-,则6NH4Cl+Fe2O3→6Fe+FeCl3+3N2↑+H2O,
再质量守恒定律可知,配平的化学反应为6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O,
故答案为:6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O;
(3)反应6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O中,N元素化合价升高,被氧化,Fe元素化合价降低,由+3价降低到0价,被还原,Fe2O3为氧化剂,由方程式可知,当4molFe2O3参加反应时,有6mol被还原,如2molFe2O3部被还原,应得到12mol电子,
故答案为:Fe2O3;得到;12.
点评 本题考查氧化还原反应得配平及有关计算,根据电子守恒及质量守恒定律得出化学反应方程式是解答本题的关键,并注意(3)是学生解答的难点和易错点,4mol Fe2O3参与反应与作氧化剂的区别,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 过量氨水溶液 | B. | 过量饱和Na2CO3 溶液 | ||
| C. | 过量CH3COOH 溶液 | D. | 过量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要知道蒸发后所得溶液的密度(ρ),就能求出溶质的摩尔质量 | |
| B. | 只要知道混合前两份溶液的物质的量浓度(c),就能求出溶质的摩尔质量 | |
| C. | 只要知道蒸发前混合液的体积(V),就能求出溶质的摩尔质量 | |
| D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
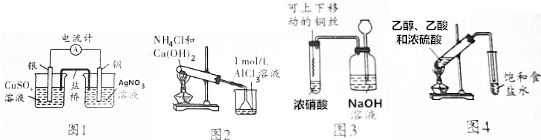
| A. | 用图1所示装置可将化学能转化为电能 | |
| B. | 用图2所示装置烧杯中先出现白色沉淀,后溶解 | |
| C. | 用图3所示装置进行铜与浓硝酸反应的实验 | |
| D. | 用图4所示装置制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
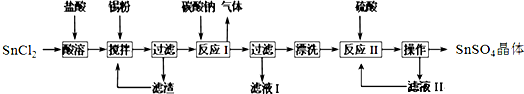
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
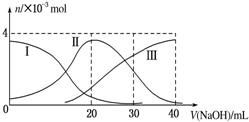
| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-?H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的底部 | |
| B. | 定容时,因不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出 | |
| C. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后再进行实验 | |
| D. | 过滤时,为加快过滤速率,可用玻璃棒快速搅拌漏斗中的悬浊液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com