
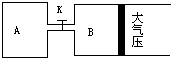
 如图所示,当关闭K时,向A中充入4molX、14molY,向B中充入2molX、7molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)?Z(g)+2W(g);△H<0.达到平衡(Ⅰ)时,B中密度变为原来的
如图所示,当关闭K时,向A中充入4molX、14molY,向B中充入2molX、7molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)?Z(g)+2W(g);△H<0.达到平衡(Ⅰ)时,B中密度变为原来的| 10 |
| 9 |
| 10 |
| 9 |
| 0.9aL |
| aL |
| 1.8mol |
| 2mol |
| 24.3mol |
| (2+7)mol |


科目:高中化学 来源: 题型:
| A、35.75g |
| B、42.15g |
| C、56.30g |
| D、71.50g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
| B、将过量SO2通入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ |
| C、向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-═NH3↑+H2O |
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+S
| ||
| B、KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2 | ||
C、碳酸钠溶液呈碱性:C
| ||
| D、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在治疗甲型流感的疫苗尚未研制面世之前,科学家一直表示,达菲类流感特效药可治疗这种新型流感病毒,它是由我国特有中药材八角的提取物--莽草酸(shikimicacid)为原料合成的.已知莽草酸结构式如图:
在治疗甲型流感的疫苗尚未研制面世之前,科学家一直表示,达菲类流感特效药可治疗这种新型流感病毒,它是由我国特有中药材八角的提取物--莽草酸(shikimicacid)为原料合成的.已知莽草酸结构式如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁和铝 | B、铁和铝 |
| C、镁和钠 | D、铁和铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNH3中含有的电子数为10NA | ||
| B、1molCl2与足量Fe反应,转移的电子数为3 NA | ||
| C、标准状况下,22.4 L氩气含氩原子数为2NA | ||
D、在1 L 0.1 mol?L-1的NH4Cl溶液中,NH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com