
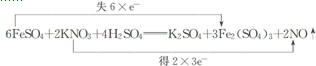 ,
,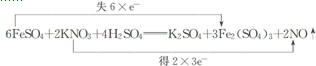 .
.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2008广东高三化学专题训练-较难氧化还原方程式的配平例解 题型:022
在热的稀硫酸中溶解了11.4 g硫酸铁,当加入50 mL 0.50 mol·L-1硝酸钾溶液时,其中的亚铁离子完全转化为铁离子,并有氮氧化物逸出:
____FeSO4+____KNO3+____ ____![]() ____K2SO4+____Fe2(SO4)3+____NxOy↑+____H2O
____K2SO4+____Fe2(SO4)3+____NxOy↑+____H2O
(1)配平该化学方程式(将含x、y的计量数和所缺物质填在横线上)
(2)反应中起氧化作用的物质是________(写化学式)
(3)推算出x、y的数值:x=________,y=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
□FeSO4+□KNO3+□H2SO4====□K2SO4+□Fe2(SO4)3+□N xO y+□H2O?
(1)推断出x=________;y=________。
(2)配平该化学方程式(化学计量数填写在上式方框内)。?
(3)上述反应中若有18 mol电子转移,则生成Fe2(SO4)3物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
A.N2O B.NO C.N2O3 D.NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com