
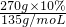 =0.2 mol;
=0.2 mol;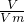 ×M可得,M=
×M可得,M=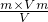 =
=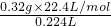 =32g/mol,
=32g/mol,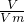 ×M计算;
×M计算;

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:








查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com