
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O,下列说法正确的是()
A. 制备高铁酸钾用ClO﹣做还原剂
B. 制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子
C. 高铁酸钾中铁的化合价为+7
D. 用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体
考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
专题: 氧化还原反应专题.
分析: 2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O中,Fe元素的化合价由+3价升高为+6价,Cl元素的化合价+1价降低为﹣1价,以此来解答.
解答: 解:A.Cl元素的化合价降低,则制备高铁酸钾用ClO﹣做氧化剂,故A错误;
B.制备高铁酸钾时1 mol Fe(OH)3失去3 mol 电子,故B错误;
C.K为+1价,O为﹣2价,由化合物中正负化合价的倒数和为0可知,高铁酸钾中铁的化合价为+6,故C错误;
D.用高铁酸钾处理水时,其还原产物为铁离子,能水解产生具有强吸附能力的胶体,从而净化水,故D正确;
故选D.
点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注重化学与生活的联系,考查点较多,题目难度不大.


科目:高中化学 来源: 题型:
室温下将浓度相同的NaOH和HCl溶液以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为()
A. 0.01mol•L﹣1 B. 0.017mol•L﹣1 C. 0.05mol•L﹣1 D. 0.50mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O请填空:
2K2CO3+6H2O请填空:
(1)充电时:①原电池的负极与电源负极相连.②阳极的电极反应式为 .
(2)放电时:负极的电极反应式为 .
(3)在此过程中若完全反应,乙池中A极的质量升高648g,则甲池中理论上消耗O2 L(标准状况下).
(4)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在下述条件下,一定能大量共存的离子组是()
A. 无色透明的水溶液中:K+、Ba2+、I﹣、MnO4﹣
B. 含有大量NO3﹣的水溶液中:NH4+、Fe2+、SO42﹣、H+
C. c(HCO3﹣)=0.1mol•L﹣1的溶液中:Na+、K+、CO32﹣、Br﹣
D. 强碱性溶液中:ClO﹣、S2﹣、HSO3﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
36.5g HCl溶解在1L水中,所得溶液的密度为ρ g•mL﹣1,质量分数为w,物质的量浓度为cmol•L﹣1,NA表示阿伏加德罗常数,则下列叙述正确的是()
A. 所得溶液的物质的量浓度:c=1mol•L﹣1
B. 所得溶液中含有NA个HCl分子
C. 36.5g HCl气体在标准状况下占有的体积约为22.4L
D. 所得溶液的质量分数:w=36.5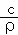
查看答案和解析>>
科目:高中化学 来源: 题型:
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9mol,这些气体恰好能被500ml 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为()
A. 0.2mol B. 0.4mol C. 0.8mol D. 0.9mol
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种短周期元素在周期表中相对位置如下表所示,Y是地壳中含量最高的元素.下列说法中不正确的是()
X Y
Z W
A. Z的原子半径大于Y
B. Y的非金属性强于W
C. W的氧化物对应的水化物都是强酸
D. X、Z的最高价氧化物均可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2几乎能与所有常见的气态非金属氧化物在一定条件下反应,如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3.
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:, .
(2)通过比较可知,当非金属元素处于 价态时,与Na2O2反应有O2生成.
(3)等物质的量的N2、O2、CO2的混合气体通过Na2O2后,体积变为原体积的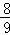 (同温同压下),这时混合气体中N2、O2、CO2物质的量之比为 .
(同温同压下),这时混合气体中N2、O2、CO2物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com