
| A. | 可能存在核外电子排布式为1s22s22p63s23p64s24p1的原子 | |
| B. | 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反 | |
| C. | 次氯酸的电子式:H?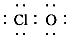 | |
| D. | 基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量 |
分析 A.核外电子排布规律是先排3d轨道,再排4p轨道;
B.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同;
C.O原子形成2个共价键;
D.根据能量守恒判断.
解答 解:A.根据能量最低原理知,核外电子排布规律是先排3d轨道,再排4p轨道,则核外电子排布式为1s22s22p63s23p63p14s2,故A错误;
B.由洪特规则可知,同一能级不同轨道上的电子自旋方向相同,即当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同,故B错误;
C.次氯酸为共价化合物,H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,则其电子式为: ,故C错误;
,故C错误;
D.基态电子的能量小于激发态电子的能量,根据能量守恒知,基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量,故D正确;
故选D.
点评 本题考查了能量最低原理、洪特规则、泡利原理、能量守恒等知识点,明确这几个原理含义是解本题关键,难度不大,侧重于考查对基本原理的应用能力.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol的铁与足量的稀硝酸反应,生成气体的分子数目为0.3 NA | |
| B. | 常温常压下,14 g由 C2H4、C3H6组成的混合气体中含有碳原子的数目为NA | |
| C. | 2.24 L CO2与足量的Na2O2反应,转移的电子总数必为0.1NA | |
| D. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g乙醇含有的C-H键数为0.6NA | |
| B. | 2gD216O含有的质子数和中子数均为NA | |
| C. | 每生成1molO2,转移的电子数一定为4NA | |
| D. | 标准状况下,22.4L NO与11.2L O2充分反应,产物分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-121.5kJ•mol-1 | |
| B. | 2CO2(g)+3H2(g)═$\frac{1}{2}$CH3OCH3(g)+$\frac{3}{2}$H2O(g)△H=-25.5kJ•mol-1 | |
| C. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=+121.5kJ•mol-1 | |
| D. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-72.5kJ•mol-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
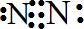 ;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D
;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 使紫色石蕊试液变红的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HS- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com