
分析 (1)碳酸的第一、二级电离方程式为H2CO3?H++HCO3-,HCO3-?H++CO32-,电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值;
(2)弱酸的电离平衡常数越大,其酸性越强,相同物质的量浓度时电离出来的氢离子浓度越大,水电离出来的氢离子浓度越小;
(3)用pH试纸测溶液pH时,把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有HF溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较,确定溶液的pH;据氢硫酸以第一步电离为主,c(HS-)=c(H+)=10-4,依此计算0.1mol/L的氢硫酸的电离度;加水稀释,促进氢硫酸电离平衡正向移动,n(H2S)减小,氢离子物质的量增大,但浓度减小,据此分析;
(4)据弱酸的电离平衡常数判断酸性强弱,根据强酸制弱酸判断离子方程式正误.
解答 解:(1)碳酸的第一、二级电离方程式为H2CO3?H++HCO3-,HCO3-?H++CO32-,电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,则K2=$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$,
故答案为:$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$;
(2)上述5种酸中,H2SO3的电离平衡常数最大,其酸性最强,所以相同物质量浓度、相同体积的上述五种酸溶液中,氢离子浓度最大的为H2SO3,HClO的电离平衡常数最小,酸性最弱,酸电离出来的氢离子浓度最小,对水的电离抑制作用最小,水电离出来的氢离子浓度最大,
故答案为:H2SO3;HClO;
(3)用pH试纸测溶液pH时,把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有HF溶液的玻璃棒点在试纸的中部,试纸变色后与标准比色卡比较,确定溶液的pH;氢硫酸以第一步电离为主,c(HS-)=c(H+)=10-4,其电离度=$\frac{1{0}^{-4}}{0.1}$×100%=0.1%;
A.加水稀释饱和氢硫酸溶液,促进电离,由于溶液的体积增大的快,所以c(HS-)减小,故A错误;
B.加水稀释饱和氢硫酸溶液,促进电离,由于溶液的体积增大的快,所以c(H+)减小,由于c(H+)×c(OH-)不变,所以c(OH-)增大,故B正确;
C.c(H+)•c(OH-)只与温度有关,故C错误;
D.加水稀释饱和氢硫酸溶液,c(H+)•c(OH-)不变,由于体积增大,所以n(H+)•n(OH-)增大,故D正确
E.加水稀释饱和氢硫酸溶液,促进电离,n(H2S)减小,n(HS-)增大,所以$\frac{c(H{S}^{-})}{c({H}_{2}S)}$增大,故E正确;
故答案为:把一小块试纸放在玻璃片上,用干燥洁净的玻璃棒沾取待测溶液,点在试纸上,对比标准比色卡,观察颜色的变化,读取pH值;0.1%;BDE;
(4)A、HClO的酸性比碳酸若比碳酸氢根离子强,所以少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-═HCO3-+HClO是正确的,故A正确;
B.次氯酸具有强氧化性能够氧化亚硫酸根离子,故B错误;
C.亚硫酸的酸性比碳酸强,所以过量SO2通入碳酸钠溶液中:2SO2+H2O+CO32-═2HSO3-+CO2是正确的,故C正确;
D.醋酸的酸性比碳酸强,过量CH3COOH加入碳酸钠溶液中应生成二氧化碳和水,故D错误;
故答案为:AC.
点评 本题考查了弱电解质的电离、电离常数等,试题知识点较多、综合性较强,难度中等,充分考查学生的分析能力及灵活应用能力,注意明确溶液酸碱性与溶液pH的关系及计算方法,注意明确电离平衡常数的应用方法.


科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃的条件下△H不相同
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下都能发生
D.化学反应的反应热可通过反应物的键能之和减去生成物的键能之和求得
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
将下列溶液与1 L 0.1 mol·L-1 NaCl溶液混合,所得溶液c(Cl-)最大的是
A.50 mL 1 mol·L-1 NaCl溶液 B.20 mL 2 mol·L-1 A lCl3溶液
lCl3溶液
C.30 mL 1 mol·L-1 MgCl2溶液 D.100 mL 3 mol·L-1 KClO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(C1O2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用Fa-14Cl、盐酸、NaCl02(亚氯酸钠)为原料制备C1O2的流程如下:
二氧化氯(C1O2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用Fa-14Cl、盐酸、NaCl02(亚氯酸钠)为原料制备C1O2的流程如下: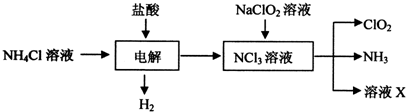
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中的值$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mlpH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
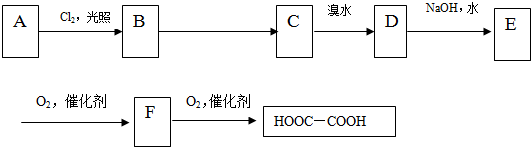
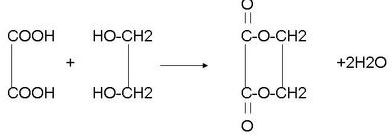 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com