
| A. | 用稀AgNO3溶液洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| B. | 对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 | |
| C. | 已知AgCl的 KSP=1.8×10-10,将AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| D. | 将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,说明AgCl溶解度大于AgI |
分析 A.硝酸银抑制AgCl的溶解平衡;
B.Al(OH)3为弱电解质;
C.AgNO3溶液与NaCl溶液混合后,c(Ag+)、c(Cl-)浓度不确定;
D.将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,发生沉淀的转化.
解答 解:A.硝酸银抑制AgCl的溶解平衡,则稀AgNO3溶液洗涤AgCl沉淀比用水洗涤损耗AgCl小,故A正确;
B.Al(OH)3为弱电解质,则Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡,故B正确;
C.AgNO3溶液与NaCl溶液混合后,c(Ag+)、c(Cl-)浓度不确定,在AgCl的饱和溶液中c(Ag+)=c(Cl-),故C错误;
D.将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,发生沉淀的转化,则AgCl溶解度大于AgI,故D正确;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握溶解平衡移动、沉淀的转化为解答本题的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | +4 | B. | +3 | C. | +2 | D. | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据实验装置图回答问题.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据实验装置图回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
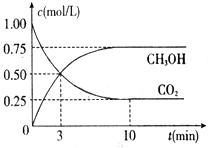
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于石墨和金刚石属于不同的单质,所以△H1和△H2不等 | |
| B. | 由于燃烧反应放热,所以△H1和△H2均取正值 | |
| C. | 由于石墨和金刚石同为碳元素组成,所以△H1=△H2 | |
| D. | 由于燃烧均为放热反应,所以石墨为重要的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(R+)>c(H+)>c(OH-) | B. | c(A-)>c(R+)>c(OH-)>c(H+) | ||
| C. | c(R+)>c(A-)>c(H+)>c(OH-) | D. | c(R+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
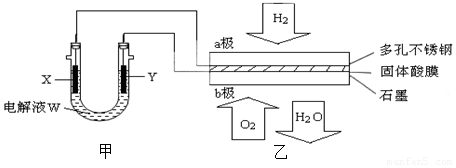
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com