
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
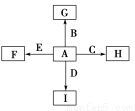
已知:
①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质。
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性。
回答问题:
(1)化合物K的电子式为________。
(2)F的水溶液呈碱性的原因(用离子方程式表示)_________________________________,写出I与J反应的化学反应方程式__________________________________________。
(3)实验室制备C的离子反应方程式为_____________________________。
(4)D在C中燃烧观察到的现象是_________________________________。
(5)可利用B与D生成化合物J的反应制成燃料电池,若1 g D在B中燃烧生成气态J时,放出120.9 kJ的热量,已知1 mol J 在汽化时吸热44.0 kJ,写出表示D的燃烧热的热化学方程式_____________________________________________________,利用K作电解质溶液,写出该燃料电池的负极的电极反应方程式________________________。
(1) 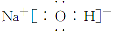
(2)S2-+H2O??HS-+OH- NaH+H2O=H2↑+NaOH
(3)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(4)苍白色火焰
(5)H2(g)+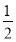 O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
2H2-4e-+4OH-=4H2O
【解析】由金属A在大气层高空释放的蒸气呈现明亮的橙黄色云雾可判断A可能为金属钠;E为有色固体,则E为单质硫,F为硫化钠;C为有色气体单质,且C与K反应的产物含漂白液的有效成分,则C为氯气,K为氢氧化钠,由此可推知B、D、J分别为氧气、氢气和水,故I为氢化钠、G为氧化钠或过氧化钠,H为氯化钠。
(5)1 g H2在O2中燃烧生成气态水放出120.9 kJ的热量,则1 mol H2在O2中燃烧生成1 mol气态水放出241.8 kJ的热量,1 mol气态水液化时又放出44.0 kJ热量,故1 mol H2在O2中燃烧生成1 mol液态水共放出285.8 kJ的热量,则其热化学方程式为:H2(g)+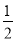 O2(g)=H2O(l) ΔH=-285.8 kJ/mol。写电极方程式时,注意其电解质溶液为碱性溶液。
O2(g)=H2O(l) ΔH=-285.8 kJ/mol。写电极方程式时,注意其电解质溶液为碱性溶液。


科目:高中化学 来源:2014年高考化学指导冲关 第13练物质结构与性质练习卷(解析版) 题型:选择题
下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钠的溶解 D.溴和汞的气化
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(二) (解析版) 题型:填空题
汽车作为一种现代交通工具正在进入千家万户,汽车尾气的污染问题也成为当今社会急需解决的问题。为使汽车尾气达标排放,催化剂及载体的选择和改良是关键。目前我国研制的稀土催化剂催化转化汽车尾气示意图如图甲:
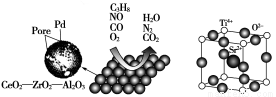
甲 乙
(1)下列有关说法正确的是________。
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.每个N2中,含有2个π键
D.CO的一种等电子体为NO+,它的电子式为[:N??O:]+
(2)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍为0价,镍原子在基态时,核外电子排布式为_____________________;[Ni(CO)4]的配体是________,配位原子是________。
(3)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是________。
(4)为了节省贵重金属并降低成本,也常用钙钛矿型复合氧化物催化剂。一种复合氧化物晶体结构如图乙,则与每个Sr2+紧邻的O2-有________个。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(三) (解析版) 题型:填空题
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
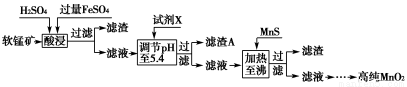
已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(三) (解析版) 题型:选择题
下列各项中物质的类别不正确的是( )
ABCD
Al2O3SiNa2O2Na2SiO3
两性氧化物单质碱性氧化物硅酸盐
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(一) (解析版) 题型:选择题
下列叙述正确的是( )
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.过量的铜与浓硝酸反应,生成的气体只有NO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。
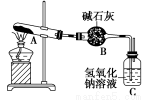
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4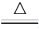 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4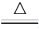 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4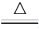 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4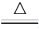 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练3 元素及其化合物练习卷(解析版) 题型:选择题
下表中各组物质不能实现如图转化的是( )

选项甲乙丙
AAlCl3AlAl(OH)3
BAlCl3Al(OH)3NaAlO2
CCO2NaHCO3Na2CO3
DCO2(NH4)2CO3NH3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:填空题
光伏并网发电并使用半导体(LED)照明可以节约大量能源。已知发出白光的LED是由氮化镓(GaN)芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的,如图所示。
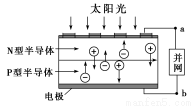
(1)砷与氮位于同主族,砷化镓也是半导体材料,它的化学式为________。
(2)用简单氧化物形式表示YAG的组成:________。
(3)下列有关光伏并网发电的叙述正确的是________(填序号)。
①LED是新型无机高分子材料
②电流从a流向b
③光伏电池是将太阳能直接转化为电能
④图中N型半导体为正极,P型半导体为负极
⑤如果工业上用光伏电池并网发电精炼粗铜,a极连接精铜电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com