
 .
.分析 A、B、C、D为同一周期的4种元素,C、D离子的电子层结构与氩原子相同,C点燃时与氧气反应生成的氧化物可与C的气态氢化物反应得到C的单质,则C为S元素;D单质常温下为气态,则D为Cl元素;0.2molA的单质与足量盐酸反应,能置换出2.24LH2(标况下),则A为金属,令A的化合价为x,根据电子转移守恒有:0.2x=$\frac{2.24}{22.4}$×2,x=1,故A为Na元素;B的氧化物既可溶于酸又可溶于强碱溶液,则B为Al,据此解答
解答 解:A、B、C、D为同一周期的4种元素,C、D离子的电子层结构与氩原子相同,C点燃时与氧气反应生成的氧化物可与C的气态氢化物反应得到C的单质,则C为S元素;D单质常温下为气态,则D为Cl元素;0.2molA的单质与足量盐酸反应,能置换出2.24LH2(标况下),则A为金属,令A的化合价为x,根据电子转移守恒有:0.2x=$\frac{2.24}{22.4}$×2,x=1,故A为Na元素;B的氧化物既可溶于酸又可溶于强碱溶液,则B为Al.
(1)由上述分析可知,A为钠元素,B为铝元素,C为硫元素,D为氯元素,故答案为:钠;铝;硫;氯;
(2)B为Al元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)C为硫元素,处于周期表中第三周期VIA族,故答案为:三;VIA.
点评 本题考查位置结构性质关系应用,熟练掌握元素化合物知识,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数目为0.5NA | |
| B. | 标准状况下,2.24 L C4H8含有的共用电子对数等于1.1NA | |
| C. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| D. | 27 g Al在标准状况下2.4 L Cl2中燃烧,转的2移的电子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
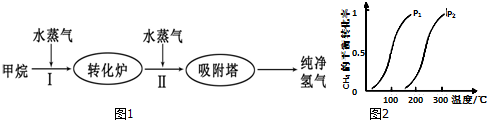
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | I1 | 中&华&资*源%库I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| V | 420 | 3100 | 4400 | 5900 |
| A. | QCl2 | B. | RCl | C. | SCl3 | D. | TCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为235 | B. | 质子数是235 | ||
| C. | 中子数为92 | D. | 与23892U是同种原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在NaOH溶液中很难水解.
在NaOH溶液中很难水解.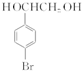 .
.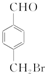 、
、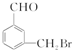 、
、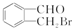 .
.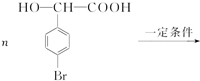
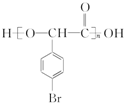 +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
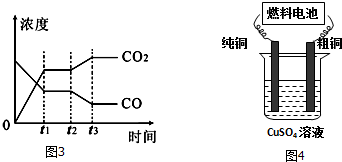
 如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )
如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )| A. | 导线中有电流通过,电流方向是由N到M | |
| B. | N上有气体放出 | |
| C. | M为正极,N为负极 | |
| D. | 是化学能转变为电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
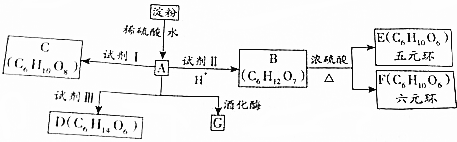
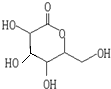 、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.
、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com