
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
分析 (1)①根据燃烧热的概念:燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
②根据化学平衡常数K计算出平衡时SO3的转化率=$\frac{物质转化量}{物质起始量}$×100%;根据2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1计算;
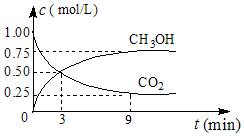
(2)①根据图象得到3min-69min内二氧化碳的转化量,计算得氢气的转化量,再由v=$\frac{△c}{△t}$计算速率;
②根据化学反应达到平衡状态时正逆反应速率相等,各物质的浓度不变,由此衍生的物理量不变;
(3)A、依据平衡常数随温度变化和平衡移动原理分析判断;
B、根据△G=△H-T△S<0自发,△G=△H-T△S>0非自发判断;
C、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、此条件是催化剂活性最大,升温平衡逆向进行;
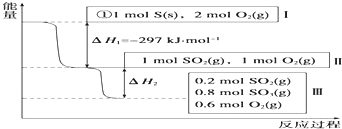
解答 解:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
(2)根据图象所给的信息可知,反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$=$\frac{0.{8}^{2}}{0.{2}^{2}×0.6}$=$\frac{80}{3}$,在相同条件下,充入1molSO3和0.5molO2,设反应达到平衡时SO3转化了Xmol,则有:
2SO2(g)+O2(g)?2SO3(g)
初始:0 0.5mol/L 1mol/L
变化:Xmol/L 0.5Xmol/L Xmol/L
平衡:Xmol/L (0.5+0.5X)mol/L (1-X)mol/L
根据温度不变,平衡常数K的值不变可知:K=$\frac{(1-X)^{2}}{{X}^{2}•(0.5+0.5X)}$=$\frac{80}{3}$解得:X=0.2mol,故反应达到平衡时SO3的转化率为$\frac{0.2mol}{1mol}×100%$=20%;三氧化硫消耗,说明反应从(1)的逆方向开始,故吸热;由热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1可知,2SO3(g)?2SO2(g)+O2(g)△H=-196.6kJ•mol-1即1molSO3分解吸收98.3KJ的热量,则0.2molSO3分解吸收的热量Q=98.3KJ×0.2=19.66KJ;
故答案为:20%;吸收;19.66;
(2)①由图象可知,3min-09min内二氧化碳浓度减少了0.25mol/L,则该时间段内氢气的浓度减少3×0.25mol/L=0.75mol/L,则v(H2)=$\frac{0.75mol/L}{6min}$=0.125mol/L;
故答案为:0.125;
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1时,没有达到平衡状态,故A错误;
B.由于气体的总质量不变,容器的体积不变,则无论是否达到平衡状态,气体的密度都不变,故B错误;
C.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故答案为:D;
(3)A、依据平衡常数随温度变化和平衡移动原理分析判断,随温度升高平衡常数减小,正反应为放热反应,故A正确;
B、由A得正反应为放热反应,△H<0,根据△G=△H-T△S<0自发,△G=△H-T△S>0非自发,又在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
,故B正确;
C、结合平衡三段式列式计算,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.1 0.2 0
变化量(mol/L) 0.1×50% 0.1 0.05
平衡量(mol/L) 0.05 0.1 0.05
平衡常数K=$\frac{0.05}{0.05×0.{1}^{2}}$=100,故C正确;
D、升温平衡逆向进行,此条件是催化剂活性最大,不是原料气的转化率高,故D错误;
故选ABC.
点评 本题既考查了燃烧热的概念、化学反应速率计算,平衡状态的判断应用,平衡常数K的应用,掌握基础是关键,综合性较强,难度适中.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
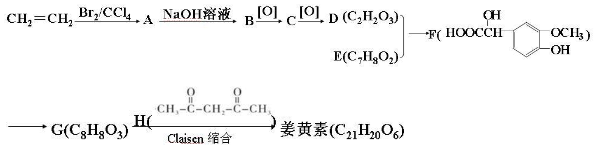
 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 
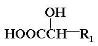 上的羟基可以氧化成羰基,再脱羧变成醛;
上的羟基可以氧化成羰基,再脱羧变成醛;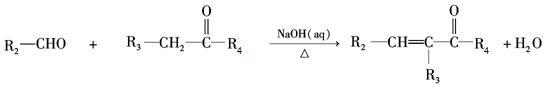 (R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为
(R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为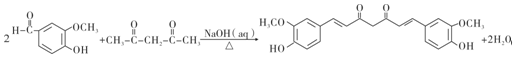
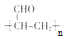 可用于合成有机高分子色素,根据Claisen缩合反应,设计
可用于合成有机高分子色素,根据Claisen缩合反应,设计 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
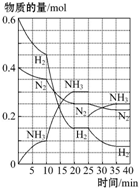 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 反应开始到第一次平衡时,N2的平均反应速率为0.062 5 mol•L-1•min-1,H2的转化率为75% | |
| B. | 反应35 min时,达到第二次平衡时,反应的平衡常数:K=$\frac{0.1{5}^{2}}{0.07{5}^{3}•0.125}$ | |
| C. | 从曲线变化可以看出,反应进行到10~20 min时可能采取的措施是使用了催化剂 | |
| D. | 从曲线变化可以看出,反应进行至25 min时,采取的措施是分离出0.1 mol的氨气,平衡向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热和中和热是反应热的种类之一 | |
| D. | 在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

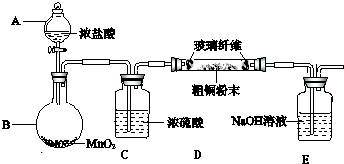
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n>p | B. | A 的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com