
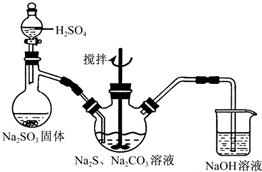
 硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.
硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.分析 蒸馏烧瓶中亚硫酸钠和硫酸反应生成二氧化硫气体,通入三颈瓶中发生反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.制取Na2S2O3,NaOH溶液的作用是吸收未反应的SO2,防止污染环境,
(1)反应过程中剩余有的二氧化硫是有毒的污染性气体,不能排放到空气中,用氢氧化钠溶液吸收;
(2)加入盐酸,Na2S2O3反应生成S沉淀,静置后取上层清液,滴加BaCl2溶液,检验溶液中是否含有硫酸根离子;
(3)①碘单质遇到淀粉变蓝色,可以指示反应的终点;
②由方程式可知:I2~2Na2S2O3与Na2SO3反应后剩余碘的物质的量:
n(I2)=0.5n(Na2S2O3)=0.5×0.02 mol/L×20.00mL=2×10-4 mol,
则与Na2SO3反应的碘的物质的量:
n(I2)=0.05 mol/L×40.00mL-2×10-4 mol=1.8×10-3 mol,
由方程式可知:Na2SO3~I2计算亚硫酸钠物质的量得到样品中Na2SO3的质量分数.
解答 解:(1)用图示装置制取Na2S2O3,反应过程中剩余有的二氧化硫是有毒的污染性气体,不能排放到空气中,其中NaOH溶液的作用是:吸收未反应的SO2,防止污染环境,
故答案为:吸收未反应的SO2,防止污染环境;
(2)检测产品中是否存在Na2SO4的实验方案为:取少量产品溶于足量稀盐酸、静置、取上层清液滴加BaCl2溶液,若出现沉淀则说明样品已经变质,反之则未变质,
故答案为:取少量样品溶于水,先加入过量稀盐酸,再滴加BaCl2溶液,若有白色沉淀生成,说明样品已经变质,反之则未变质;
(3)①准确称取0.2500g Na2SO3样品于锥形瓶中,并加入40.00mL 0.05000mol•L-1标准碘溶液,过量的碘用0.02000mol•L-1Na2S2O3标准溶液进行滴定,依据碘单质遇到淀粉变蓝色可知应选择淀粉溶液作指示剂,滴定到终点溶液蓝色褪去,
故答案为:淀粉溶液;
②由方程式可知:I2~2Na2S2O3与Na2SO3反应后剩余碘的物质的量:
n(I2)=0.5n(Na2S2O3)=0.5×0.02 mol/L×20.00mL=2×10-4 mol,
则与Na2SO3反应的碘的物质的量:
n(I2)=0.05 mol/L×40.00mL-2×10-4 mol=1.8×10-3 mol,
由方程式可知:Na2SO3~I2
n(Na2SO3)=n(I2)=1.8×10-3 mol,
w(Na2SO3)=1.8×10-3 mol×126 g•mol-1/0.25 g=90.72%,
答:样品中Na2SO3的质量分数90.72%.
点评 本题考查实验方案方案,涉及对操作的分析评价、离子检验、化学计算等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时沸石的作用是防止液体受热时突然沸腾(爆沸) | |
| B. | 蒸馏操作时,需要将温度计水银球插入到蒸馏液体的液面以下 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液全部蒸干 | |
| D. | 用浓硫酸配制稀硫酸时,可将量取好的浓硫酸直接转移至容量瓶后再加水定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH4 分子中含 10NA个电子 | B. | 22.4LCH4 分子中含 4NA 个共价键 | ||
| C. | 乙烯不能使溴水褪色 | D. | 苯属于烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L | B. | 2.0mol/L | C. | 3.0mol/L | D. | 4.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
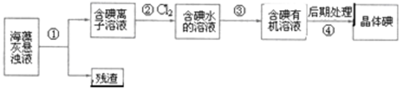
| A. | 步骤①、③的操作分别是过滤、萃取分液 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、NO3-、Cl- | B. | Br-、Fe2+、Fe3+、SO42- | ||
| C. | Na+、SO32-、K+、NO3- | D. | K+、Na+、I -、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体形状改变且质量减少 | |
| B. | 晶体形状改变而质量不变 | |
| C. | 晶体形状和质量都不变 | |
| D. | 硫酸铜溶液的物质的量浓度有所增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com