


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
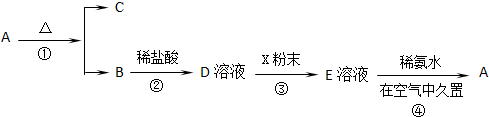
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、元素④、⑦、⑨的单质的氧化性依次减弱,所以在水溶液中④的单质可以置换出⑦、⑨的单质 |
| B、因为氢键关系,气态氢化物的稳定性③大于⑥ |
| C、元素⑤的单质与元素②的最高价氧化物对应的水化物反应时,参加反应的⑤单质与生成氢气的物质的量之比为2:3 |
| D、离子半径:⑥>⑦>③>④>⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
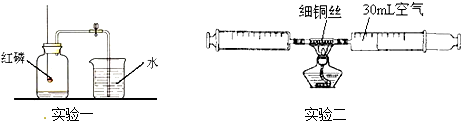
| A、2个 | B、3个 | C、4个 | D、5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑥ | B、①②⑤⑥ |
| C、①③⑥ | D、①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2s末氨气的反应速率=0.4mol?(L?s)-1 |
| B、前2s时间内氨气的平均反应速率=0.4mol?(L?s)-1 |
| C、前4s时间内氨气的平均反应速率=0.3mol?(L?s)-1 |
| D、2~4s时间内氨气的平均反应速率=0.2mol?(L?s)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com