
| A. | 蒸发结晶时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,溶液的液面高于滤纸的边缘 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从上口倒到另一个烧杯中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
分析 A.蒸发时,不能蒸干,利用余热加热;
B.过滤时遵循一贴二低三靠;
C.分液时避免上下层液体混合;
D.萃取时,不能发生反应,溶质在不同溶剂中的溶解性差异较大.
解答 解:A.蒸发时,不能蒸干,利用余热加热,则蒸发结晶时出现大量的晶体可停止加热,故A错误;
B.过滤时遵循一贴二低三靠,则过滤时,溶液的液面应低于滤纸的边缘,故B错误;
C.分液时避免上下层液体混合,则下层液体从分液漏斗下口放出后,再将上层液体从上口倒到另一个烧杯中,故C正确;
D.萃取时,不能发生反应,溶质在不同溶剂中的溶解性差异较大,不需要考虑萃取剂与水的密度大小,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验、实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验基本操作及实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
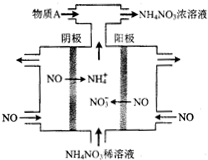
| A. | NO是常见的大气污染物之一,该装置可实现废气的治理与回收利用 | |
| B. | 阳极反应为:NO-3e-+2H2O═NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+═NH4++H2O | |
| D. | 为使电解产物全部转化为NH4NO3,需向该电解池中补充水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛溶液浸泡生物样本 | |
| B. | 强酸、强碱对蛋白质的腐蚀 | |
| C. | 重金属盐使人和动物中毒 | |
| D. | 浓的硫酸铵溶液使鸡蛋清溶液析出固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于p% | B. | 大于p% | ||
| C. | 小于p% | D. | 达到平衡的时间乙更长 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com