
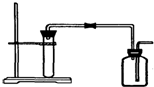
| A. | 用Zn粒与稀HCl反应制H2 | B. | 用大理石与稀HCl反应制CO2 | ||
| C. | 用Cu与稀HNO3反应制NO | D. | 用MnO2与浓HCl反应制Cl2 |
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
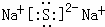 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
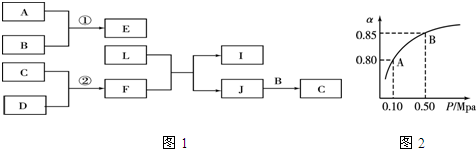
 ;J的结构式
;J的结构式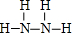 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
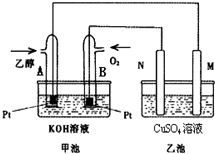 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )| A. | C12 | B. | N2 | C. | S | D. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 1mol•L-1FeCl3溶液中含阳离子数为0.1NA | |
| B. | 标准状况下,2.24L乙醛完全燃烧所得CO2分子数为0.2NA | |
| C. | 0.6gCaCO3与KHCO3的混合物中所含质子数为0.3NA | |
| D. | 80Ml 10mol•L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c (Na+)>c (B-)>c (H+)>c (OH-) | |
| B. | 常温时,pH均为2的CH3COOH溶液和HCl溶液,pH均为12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4中c (NH$_4^+$)由大到小的顺序是:②>①>④>③ | |
| D. | 0.1 mol/L NaHB溶液中其pH为4:c(HB-)>c(H2B)>c(B$_{\;}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “纳米材料”是指微粒直径为几纳米到几十纳米的材料,故纳米材料是胶体 | |
| B. | 用丁达尔效应可区分胶体和溶液 | |
| C. | 分散剂一定是液体 | |
| D. | 将饱和FeCl3溶液滴入NaOH浓溶液中,可制得Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com