
| A、以O2浓度变化表示的反应速率为0.064 mol?(L?s)-1 | ||
| B、反应达到平衡状态时NH3的转化率为20% | ||
C、升高温度能使
| ||
| D、将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol?L-1 |
| △c |
| △t |
| △c |
| △t |
| 0.8mol/L |
| 10S |
| 5 |
| 4 |
| 1.6mol |
| 4mol |
| n(NO) |
| n(NH3) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
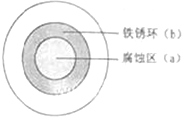
| A、液滴中的Cl-由a 区向b区迁移 |
| B、液滴边缘区发生的电极反应为:2H++2e-=H2 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a 区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、导致该现象的主要原因是液滴之下氧气含量比边缘处少. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B、硫酸工业中,接触室内安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C、氯碱工业中,使用离子交换膜可防止C12和NaOH溶液反应 |
| D、电镀工业中,必需将镀件与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
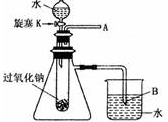 用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:
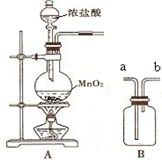 实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题:
实验室用如图所示装置A、B进行组合制取氯气,按要求回答下列问题:| 实验目标 | 装填试剂 (填选项字母) | 气体流向 (填a、b) |
| 除去HCl杂质 | E | a→b |
| 干燥氯气 | C | a→b |
| 收集氯气 | D | |
| 检验氯气的氧化性 | F |
查看答案和解析>>
科目:高中化学 来源: 题型:
 海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.从海水中得到的粗盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入氯化钡、氢氧化钠、碳酸钠等物质(均过量)将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图:
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.从海水中得到的粗盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入氯化钡、氢氧化钠、碳酸钠等物质(均过量)将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图: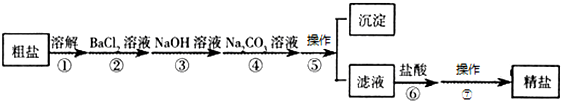
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
A、
| ||
B、
| ||
| C、7 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
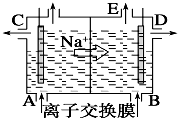
| A、从E口逸出的气体是H2 |
| B、从B中加入含少量NaOH的水溶液以增强导电性 |
| C、标准状况下每生成22.4LCl2,便产生2molNaOH |
| D、完全电解后加适量盐酸可以恢复到电解前的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com