
将等质量的锌粒(wg)分别投入VL pH=2的盐酸和醋酸(含醋酸n mol),结果发现一种溶液中Zn有剩余,有关叙述正确的是( )
|
| A. | 0.325V<w<32.5n |
|
| B. | 产生H2的平均反应速率盐酸大于醋酸 |
|
| C. | 产生H2的量盐酸多于醋酸 |
|
| D. | 与醋酸反应时锌有剩余 |
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
醋酸为弱酸,不能完全电离,pH=2的盐酸和醋酸,醋酸浓度较大,盐酸溶液中溶质的物质的量较小,则结果发现一种溶液中Zn有剩余,应为与盐酸反应时锌剩余,以此解答.
解答:
解:A.n(HCl)=0.01Vmol,醋酸的物质的量为nmol,则消耗锌的物质的量应介于0.005Vmol~0.5nmol之间,质量为0.325V<w<32.5n,故A正确;
B.醋酸浓度较大,随着反应的进行,醋酸进一步电离出氢离子,则醋酸反应速率较大,故B错误;
C.因锌与盐酸反应过量,则醋酸生成氢气较多,故C错误;
D.与醋酸反应时锌有不足,与盐酸反应时锌过量,故D错误.
故选A.
点评:
本题考查弱电解质的电离,为高频考点,侧重于学生的分析能力能力的考查,注意把握弱电解质的电离特点,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在BaSO3(s)⇌Ba2+(aq)+SO32﹣ (aq)平衡体系中,下列措施可使沉淀量减少的是( )
|
| A. | 加入K2SO3(s) | B. | 加入稀HNO3 | C. | 加入稀盐酸 | D. | 加入K2SO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,固定体积的容器中充入1mol SO2和1mol O2,再加入少量的NO,在体系中发生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法中不正确的是( )
|
| A. | 体系中的总反应是:2SO2+O2⇌2SO3 |
|
| B. | 在反应过程中NO是催化剂 |
|
| C. | NO参与反应历程,降低反应活化能,加快反应速率 |
|
| D. | NO的引入可以增加SO2的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
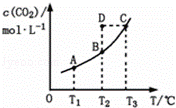
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
|
| A. | 反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的△H>0 |
|
| B. | 在T2时,若反应处于状态D,则一定有ν正<ν逆 |
|
| C. | 平衡状态A与C相比,平衡状态A的c(CO)小 |
|
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在生产、生活、国防上有重要的应用.例如:
联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
①已知:2NO2(g)⇌N2O4(g)△H=﹣57.20kJ•mol﹣1.
一定温度下,在密闭容器中反应2NO2(g)⇌N2O4(g)达到平衡.
其他条件不变时,下列措施能提高NO2转化率的是 (填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
②下表为反应2NO2(g)⇌N2O4(g)在17℃、1.01×105Pa下的部分实验数据:
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol•L﹣1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol•L﹣1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
该温度下反应N2O4(g)⇌2NO2(g)的平衡常数K的值为 .
(写出计算过程)
③25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.
则该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、CO32﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()
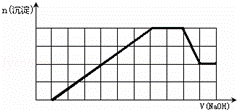
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42﹣和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。


(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com