
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的结构简式为_______。
(2)D分子中最多有_____个碳原子共平面,与D化学式相同且符合下列条件的同分异构体有_______种。(①与D具有相同的官能团,②苯环上的三元取代物)
(3)⑤的化学方程式为________。
(4)参照上述合成路线,若要合成最终产物为![]() 有机物,需要_________和_____________两种有机物通过一步反应制得。(在横线上写出有机物的结构简式)
有机物,需要_________和_____________两种有机物通过一步反应制得。(在横线上写出有机物的结构简式)
【答案】![]() 10 6
10 6 ![]() +2KOH
+2KOH![]()
![]() +2KBr+2H2O
+2KBr+2H2O ![]()
![]()
【解析】
由B的结构可知反应①为取代反应,A为![]() ,B发生还原反应生成C,D能与溴的四氯化碳反应生成E,E在氢氧化钾、乙醇条件下反应得到F,可知E为卤代烃,D含有不饱和键,故反应③为消去反应,则D为
,B发生还原反应生成C,D能与溴的四氯化碳反应生成E,E在氢氧化钾、乙醇条件下反应得到F,可知E为卤代烃,D含有不饱和键,故反应③为消去反应,则D为![]() ,E为
,E为![]() ,F为
,F为![]() ,由M的分子式可知,反应⑦为取代反应,M的结构简式为
,由M的分子式可知,反应⑦为取代反应,M的结构简式为![]() 。单取代芳烃A、G互为同系物,则G的结构简式为
。单取代芳烃A、G互为同系物,则G的结构简式为![]() ,据此解答。
,据此解答。
(1)分析可知A的结构简式为![]() ;
;
(2)D为![]() ,含有碳碳双键,苯环为平面结构、碳碳双键为平面结构,旋转碳碳单键可以使2个平面共面,通过旋转可以使乙基中C原子处于上述平面内,即所有的碳原子都可能共面,分子中最多有10个碳原子共平面;D的同分异构体①与D具有相同的官能团,②苯环上的三元取代物,则取代基分别为-CH3、-CH3、-CH=CH2,根据两固定、一游动原则,两甲基固定在苯环的邻位,-CH=CH2有2种位置;固定在间位,-CH=CH2有3种位置,固定在对位,-CH=CH2有1种位置,合计6种同分异构体;
,含有碳碳双键,苯环为平面结构、碳碳双键为平面结构,旋转碳碳单键可以使2个平面共面,通过旋转可以使乙基中C原子处于上述平面内,即所有的碳原子都可能共面,分子中最多有10个碳原子共平面;D的同分异构体①与D具有相同的官能团,②苯环上的三元取代物,则取代基分别为-CH3、-CH3、-CH=CH2,根据两固定、一游动原则,两甲基固定在苯环的邻位,-CH=CH2有2种位置;固定在间位,-CH=CH2有3种位置,固定在对位,-CH=CH2有1种位置,合计6种同分异构体;
(3)⑤为卤代烃的消去反应,化学方程式为:![]() +2KOH
+2KOH![]()
![]() +2KBr+2H2O;
+2KBr+2H2O;
(4)苯乙烯与溴发生加成反应得到![]() ,再在KOH/乙醇条件下发生消去反应生成
,再在KOH/乙醇条件下发生消去反应生成![]() ,甲苯通过I2/HIO3、CH3COOH/H2SO4得到
,甲苯通过I2/HIO3、CH3COOH/H2SO4得到![]() ,
,![]() 与
与![]() 发生取代反应得到
发生取代反应得到![]() 。
。


科目:高中化学 来源: 题型:
【题目】硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO45H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:
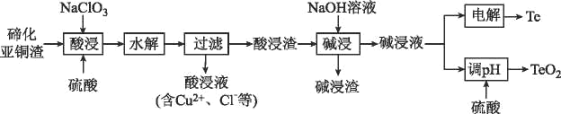
已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:

选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃时SiHCl3的转化率随时间变化的结果如图所示。下列叙述正确的是
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃时SiHCl3的转化率随时间变化的结果如图所示。下列叙述正确的是
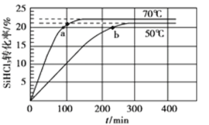
A.正反应方向为放热反应
B.反应速率大小:va <vb
C.70 ℃时,平衡常数K =![]()
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分,Ⅰ是一种萜类化合物,它的合成路线如图所示:
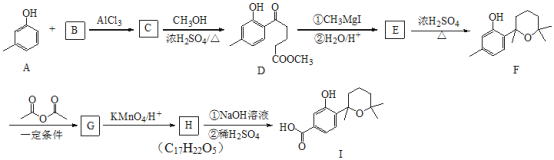
已知:
Ⅰ.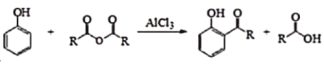
Ⅱ.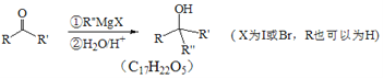
Ⅲ.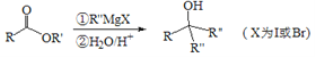
回答下列问题:
(1)A的名称是________,![]() 的反应类型是_________;
的反应类型是_________;
(2)流程中设计![]() 这步反应的作用________;
这步反应的作用________;
(3)![]() 第一步的化学反应方程式__________;
第一步的化学反应方程式__________;
(4)B含有一个环状结构,其结构简式为__________;它的同分异构体有多种,其中符合下列条件的有____________种(不考虑立体异构)
①不含有环状结构 ②能发生银镜反应 ③能与![]() 反应生成
反应生成![]()
(5)F与![]() 按物质的量
按物质的量![]() 发生反应生成G的化学方程式为_________;
发生反应生成G的化学方程式为_________;
(6)请以![]() 、
、![]() 为原料,结合题目所给信息,制备高分子化合物
为原料,结合题目所给信息,制备高分子化合物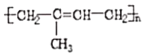 的流程________。
的流程________。
例如:原料![]() ……目标化合物
……目标化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.NaHCO3 = Na++H++CO32-
B.(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
C.H2S![]() 2H++S2-
2H++S2-
D.Al(OH)3![]() H++AlO2-+H2O
H++AlO2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 与 H2 合成(CH3)2O(二甲醚)是煤化工中的重要反应,有关信息如下:2CO2(g)+6H2(g) ![]() (CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
(CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
A.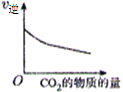 B.
B.
C.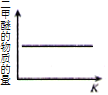 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
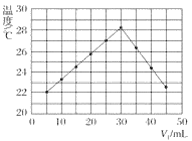
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
① | 298 | 0.20mol/L |
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
② | 308 | 0.20mol/L |
| |
③ | 298 | 0.40mol/L |
| |
④ | ______ |
| 0.20mol/L |
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
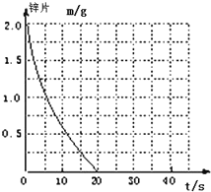
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )
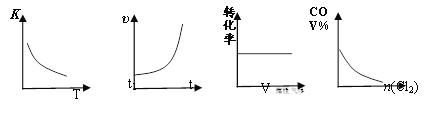
① ② ③ ④
A. ①表示随温度升高,平衡常数的变化
B. ②表示加入催化剂,反应速率随时间的变化
C. ③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D. ④表示CO的体积分数随充入Cl2量的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com