
【题目】2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )

A.该装置将太阳能直接转化为化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O=CO+2OH-
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法错误的是( )

A.Z、Y、X的原子半径依次减小,非金属性依次降低
B.Z、Y、W的最高价氧化物的水化物的酸性依次降低
C.W与Y两种元素都存在多种同素异形体
D.Y的气态氢化物与Z的单质在一定条件下可发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中的溴含量约为65mg·L-1,从海水中提取溴的工业流程如图:
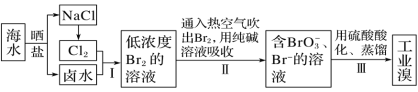
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的______(填字母)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数,并将配平后的反应写在答题纸相应位置。_____
![]()
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为_____。
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有______(填字母)。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
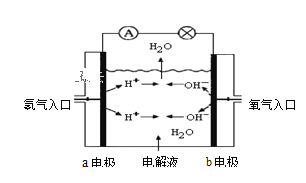
【题目】Ⅰ.下图为氢氧燃料电池原理示意图,按下图的提示,回答以下问题:
(1)若电解质溶液为KOH溶液,则写出电极反应式:![]() 极 ____________,
极 ____________,![]() 极 _______________。
极 _______________。
(2)若电解质溶液为稀H2SO4,则写出电极反应式:![]() 极 _____________,
极 _____________,![]() 极 _______________。
极 _______________。
Ⅱ.氨基甲酸铵分解反应为NH2COONH4(s) ![]() 2NH3(g)+CO2(g),在体积不变的密闭容器中发生反应,可以判断该反应已经达到平衡的是__________。
2NH3(g)+CO2(g),在体积不变的密闭容器中发生反应,可以判断该反应已经达到平衡的是__________。
A.密闭容器中氨气的体积分数不变 B.1molNH2COONH4分解同时有44gCO2消耗
C.密闭容器中混合气体的密度不变 D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
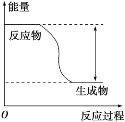
(1)该反应为_____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是_____(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。铜片上的现象为_____,该极上发生的电极反应为_____,外电路中电子由_____移动。(填“正极向负极”或“负极向正极”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,进行如下反应:C(s)+ H2O(g)CO(g)+ H2(g)
(1)若容器容积为2L,反应10s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为___mol/(L·s)。
(2)若增加碳的量,则正反应速率_____。(选填“增大”、“减小”、“不变”)
(3)该反应达到平衡状态的标志是______。
a.压强不变 b.v正(H2)= v正(H2O) c.c(CO)不变 d.c(H2O)= c(CO)
(4)若升高温度,平衡向右移动,则正反应是___________反应。(选填“吸热”或“放热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
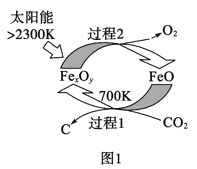
【题目】二氧化碳的利用是我国能源领域的一个重要战略方向,目前我国科学家在以下方面已经取得重大成果。
(1)图1是由CO2制取C的太阳能工艺。已知过程1发生的反应中![]() =6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
=6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
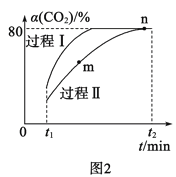
(2)利用CO2合成甲醇的反应为:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
(3)用二氧化碳合成低密度聚乙烯(LDPE)。以纳米二氧化钛膜为工作电极,常温常压电解CO2,可制得LDPE,该电极反应可能的机理如图3所示。
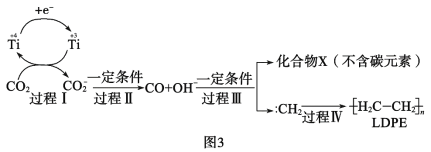
①过程Ⅰ~Ⅲ中碳元素发生__反应(填“氧化”或“还原”)。
②请补充完整并配平CO2转化为LDPE的电极反应:2nCO2+___+___=![]() +___。__
+___。__
③工业上生产1.4×104g的LDPE,理论上需要标准状况下CO2的体积是__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是俄罗斯化学家门捷列夫提出“元素周期律”150周年。门捷列夫为好几种当时尚未发现的元素(如“类铝”“类硅”和“类硼”)留下了空位。而法国科学家在1875年研究闪锌矿(ZnS)时发现的“镓”,正是门捷列夫预言的“类铝”,其性质也是和预言中的惊人相似。请回答下列问题:
(1)①基态镓原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形;门捷列夫预言的“类硼”就是现在的钪,“类硅”即是现在的锗。在镓、钪、锗三种元素的原子中,未成对电子数最多的是_________ (填元素符号)。
②下列说法中,最有可能正确的一项是_________(填字母代号)。
A 类铝在100℃时蒸气压很高 B 类铝的氧化物一定不能溶于强碱溶液
C 类铝一定不能与沸水反应 D 类铝能生成类似明矾的矾类
(2)氯化镓晶体熔点为77.9℃。氯化镓分子中镓的杂化方式为_______,空间构型为_______;写出与氯化镓互为等电子的的分子、离子各一种:_______、_______。
(3)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,GaN、GaP、GaAs晶体的熔点如下表所示,分析其变化原因:__________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(4)2011年,我国将镓列为战略储备金属,我国的镓储量约占世界储量的80%以上。砷化镓也是半导体材料,其结构与硫化锌类似,其晶胞结构如下图所示:

①原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中A(0,0,0)、B(![]() )、C(1,
)、C(1,![]() ,
,![]() ),则此晶胞中,距离A球最远的黑球的坐标参数为______________。
),则此晶胞中,距离A球最远的黑球的坐标参数为______________。
②若砷和镓的原子半径分别为a cm和b cm,砷化镓的摩尔质量为M g/mol,密度为![]() g/cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为_________ (用含a、b、M、
g/cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为_________ (用含a、b、M、![]() 、NA的代数式表示,NA表示阿伏加德罗常数的值)。
、NA的代数式表示,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,3.2gO2中氧分子数为0.1NA
B.标准状况下,22.4L正己烷中碳原子数为6NA
C.78gNa2O2在足量CO2中充分反应转移的电子数约为2NA
D.密闭容器中,3molH2和1molN2充分反应后氨分子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com