
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1<p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1<p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a=b |
分析 压强p1<p2,增大压强,G的体积分数增大,说明平衡逆向移动,增大压强,平衡向气体体积减小的方向移动;
压强不变时,升高温度,G的体积分数减小,升高温度平衡向吸热反应方向移动,据此分析解答.
解答 解:A.压强不变时,升高温度,G的体积分数减小,平衡正向移动,升高温度平衡向吸热反应方向移动,则正反应是吸热反应,故A错误;
B.根据A知,该反应的正反应是吸热反应,故B正确;
C.温度一定时,增大压强,G的体积分数增大,说明平衡逆向移动,增大压强平衡向气体体积减小的方向移动,则a<b,故C错误;
D.根据C知,a<b,故D错误;
故选B.
点评 本题以图象分析为载体考查化学平衡影响因素,为高频考点,采用“定一议二”的方法确定反应热和气体计量数之和,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| C. | 在石油分馏的实验中,需要在蒸馏烧瓶中加入碎瓷片 | |
| D. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
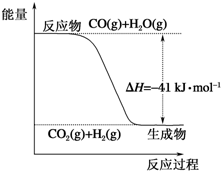 (1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.
(1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液中加入过量NaOH溶液 HCO3-+OH-=H2O+CO32- | |
| B. | 向次氯酸钠溶液中通入少量的CO2 2ClO-+H2O+CO2=2HClO+CO32- | |
| C. | 向乙二酸(H2C2O4)溶液中滴入少量氢氧化钠溶液 H2C2O4+2OH-=C2O42-+2H2O | |
| D. | 氯化亚铁溶液中加入稀硝酸 3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,若转移了NA个电子,则阳极质量减少32 g | |
| B. | 1molSiO2中有2NA个硅氧键 | |
| C. | 1 mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目小于NA | |
| D. | 1mol Cl2与过量的铁反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性最强的是HZ | |
| B. | 室温下,可用Y的容器盛装稀硝酸 | |
| C. | 原子半径由小到大的顺序为:rW<rM<rY | |
| D. | X的单质可通过电解XZ的水溶液获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇中含乙酸杂质:加入足量氧化钙,蒸馏 | |
| B. | 制氯气时,依次通过饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | CO2中混有H2S通过足量的浓硫酸溶液洗气,以得到纯净的CO2 | |
| D. | 通过灼热的镁粉除去N2中的O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com