
下列有关反应热的说法正确的是( )
A.吸热反应需不断从外界获得能量,放热反应不需从外界获得能量
B.甲烷的燃烧热△H=-890kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ·mol-1
C.已知常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ·mol-1
D.已知:S(s)+O2(g)=SO2(g)△H1=-Q1 kJ·mol-1,S(g)+O2(g)=SO2(g)△H2=-Q2kJ·mol-1,则Q1<Q2
科目:高中化学 来源:2015-2016学年黑龙江大庆一中高二下第二次段考化学试卷(解析版) 题型:选择题
下列关于有机物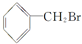 的说法中不正确的是( )
的说法中不正确的是( )
A.所有的碳原子在同一个平面上
B.水解生成的有机物可与NaOH溶液反应
C.不能发生消去反应
D.能够发生加成反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古平煤高中高一实验班下期中化学卷(解析版) 题型:选择题
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
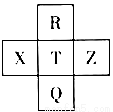
A.非金属性:Z<T<X B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q D.最高价氧化物的水化物的酸性:T<Q
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古平煤高中高一实验班下期中化学卷(解析版) 题型:选择题
某元素X最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中X元素的化合价为( )
A.5n-2 B.3n-12 C.3n-6 D.n-10
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:填空题
硅单质及其化合物应用范围广。请回答下列问题:
(1)制备硅半导体材料必须先得到高醇硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式 .
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种物质。写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 .
(2)下列有关硅材料的说法正确的是 (填字母)。
A.高纯度的硅,可用于生产光电池,将光能直接转换为电能
B.氮化硅硬度大.熔点高.可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料----光导纤维
D.普通玻璃是由纯碱.石灰石和石英砂制成的
E.盐酸可以与硅反应.故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃,取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:选择题
将盛有NH4HCO3的试管加热,使放出的气体依次通过盛有足量Na2O2的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
A.O2 B.NH3 C.H2O D.CO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:选择题
下列各组物质中,化学键的类型相同的是( )
A.Na2O和Na2O2 B.CaCl2和Na2S C.N2和Ne D.HCl和NaOH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽六安一中高一下周末作业四化学试卷(解析版) 题型:选择题
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。己知:1 mol S (s)转化为气态硫原子吸收能量280kJ,断裂1mol F—F、S—F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g),产生1mol SF6(g)的反应的热量变化为
A.放出1780kJ B.放出1220kJ C.吸收1780kJ D.吸收1220kJ
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(天津卷参考版) 题型:简答题
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH?  FeO42?+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42?,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42?+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42?,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。


①电解一段时间后,c(OH?)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c( Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com