
| A. | 溶液中$\frac{c(M{g}^{2+})}{c(M{n}^{2+})}$=$\frac{1}{100}$ | |
| B. | 若加入少量NaOH,Ksp[Mg(OH)2]和Ksp[Mn(OH)2]均减小 | |
| C. | 若加入少量MgCl2,溶液中c(Mg2+)和c(Mn2+)均增大 | |
| D. | 若升高温度,Mg(OH)2和Mn(OH)2两种固体的质量均不变 |
分析 A.溶液中$\frac{c(M{g}^{2+})}{c(M{n}^{2+})}$=$\frac{Ksp[Mg(OH)_{2}]}{Ksp[Mn(OH)_{2}]}$;
B.Ksp只与温度有关;
C.若加入少量MgCl2,c(Mg2+)增大,Mg(OH)2的溶解平衡逆向移动,氢氧根离子浓度减小,由Ksp[Mn(OH)2]不变分析;
D.溶解平衡为吸热反应.
解答 解:A.溶液中$\frac{c(M{g}^{2+})}{c(M{n}^{2+})}$=$\frac{Ksp[Mg(OH)_{2}]}{Ksp[Mn(OH)_{2}]}$=$\frac{2.0×1{0}^{-11}}{2.0×1{0}^{-13}}$=$\frac{100}{1}$,故A错误;
B.Ksp只与温度有关,则若加入少量NaOH,Ksp[Mg(OH)2]和Ksp[Mn(OH)2]均不变,故B错误;
C.若加入少量MgCl2,c(Mg2+)增大,Mg(OH)2的溶解平衡逆向移动,氢氧根离子浓度减小,由Ksp[Mn(OH)2]不变可知,c(Mn2+)增大,故C正确;
D.溶解平衡为吸热反应,则升高温度,溶解平衡正向移动,固体质量均减小,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算及影响因素为解答的关键,侧重分析与应用能力的考查,注意选项C中引入镁离子使其浓度增大,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 9.5 | C. | 10.5 | D. | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
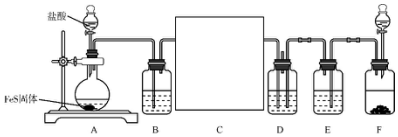

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 实验操作 | 实验现象 |
| ① | 滴入KSCN溶液 | 溶液变红色 |
| ② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| ③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| ④ | 滴入淀粉溶液 | 溶液变蓝色 |
| A. | ②和④ | B. | ①和③ | C. | ③和④ | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向等物质的量浓度的NaNO3溶液和Na2SiO3溶液中分别滴加3滴酚酞溶液 | NaNO3溶液为无色,Na2SiO3溶液变成红色 | 非金属性:N>Si |
| B | 将湿润的KI-淀粉试纸置于集满某气体的集气瓶口 | 试纸变蓝 | 该气体为Cl2 |
| C | 将浓盐酸滴入NaHSO3溶液,所得气体依次通过浓硫酸和CuSO4,收集气体 | CuSO4颜色未发生改变 | 收集到纯净的SO2 |
| D | 向含有少量FeCl3的FeCl2溶液中加入铜粉 | 铜粉有剩余 | 所得溶液中的溶质只有FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯(
乙苯(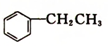 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途. (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al3+$\stackrel{过量氨水}{→}$AlO${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| D. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq) $\stackrel{NaOH(aq)}{→}$Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com