
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l) ΔH<0
一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因
素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
 (1)该实验探究的是 ▲ 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: ▲ < ▲ (填实验序号)
(1)该实验探究的是 ▲ 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: ▲ < ▲ (填实验序号)
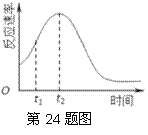
(2)研究发现反应速率总是如右图所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,
② ▲ 。
(3) 若实验①在4 min末收集了4.48 mL CO2(标准状况),则4 min末c(MnO4-)= ▲ mol·L-1(假设溶液混合后体积为50 mL),此4 min内的平均速率为v(H2C2O4)= ▲ 。
(4)除通过测定一定时间内CO2的体积比较反应速率,本实验还可以通过测定
▲ 比较化学反应速率。
科目:高中化学 来源: 题型:
已知 2Fe3+ +2I- =2Fe2+ +I2 2Fe2+ +Cl2 =2Fe3+ +2Cl- 则有关离子的还原性由强到弱的顺序为 ( )
A.Cl->Fe2+>I- B. Fe2+>I->Cl- C.I->Fe2+>Cl- D.Fe2+>Cl->I-
查看答案和解析>>
科目:高中化学 来源: 题型:
现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为( )
A.1.0g B.2.0g C.2.5g D.3.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
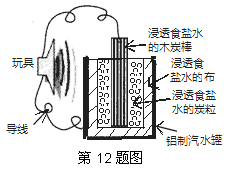 右图是一个用废旧材料制作的可用于驱动玩具的电池示意图,该电池工作时,有关说法正确的是
右图是一个用废旧材料制作的可用于驱动玩具的电池示意图,该电池工作时,有关说法正确的是
A.木炭棒应与玩具电机的负极相连
B.炭粒和炭棒上发生的电极反应是:O2+4e-=2O2-
C.铝罐将逐渐被腐蚀
D.因为一开始反应就会生成大量氯气,该电池有一定
的危险性
查看答案和解析>>
科目:高中化学 来源: 题型:
在图1所示密闭容器中充满红棕色的NO2气体,当迅速将活塞向右推一段距离后保持活塞
不动时,色度计测出颜色变化的情况如图2所示。如果迅速将活塞往左拉一段距离后保持活塞
不动时,色度计测出颜色变化的情况正确的图示为


图1 图2


A. B. C. D.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.HNO3的摩尔质量为63
B.摩尔是物质的量的单位
C.1 mol任何物质都约含有6.02×1023个原子
D.64 g SO2中含有1mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
现用18.4 mol·L-1的浓硫酸配制450mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:
①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)计算所需浓硫酸的体积为___________mL(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏高的有____________(填序号)
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2[NaAl(OH )4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com