
| A. | 112 mL | B. | 224 mL | C. | 448 mL | D. | 560 mL |
分析 0.96gCu的物质的量=$\frac{0.96g}{64g/mol}$=0.015mol,n(SO42- )=4mol/L×0.01L=0.04mol,n(NO3-)=2mol/L×0.01L×1=0.02mol,n(H+)=2n(SO42- )+n(NO3-)=0.08mol+0.02mol=0.1mol,Cu和稀硝酸发生的离子反应方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,根据物质间的反应来分析解答.
解答 解:0.96gCu的物质的量=$\frac{0.96g}{64g/mol}$=0.015mol,
n(SO42- )=4mol/L×0.01L=0.04mol,
n(NO3-)=2mol/L×0.01L×1=0.02mol,
n(H+)=2n(SO42- )+n(NO3-)=0.08mol+0.02mol=0.1mol,
Cu和稀硝酸发生的离子反应方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
根据方程式知,Cu完全溶解需要n(H+)=$\frac{8}{3}$n(Cu)=$\frac{8}{3}$×0.015mol=0.04mol<0.1mol,
需要n(NO3-)=$\frac{2}{3}$n(Cu)=$\frac{2}{3}$×0.015mol=0.01mol<0.02mol,所以硝酸有剩余,
根据铜的量计算生成气体体积,设生成气体体积为V,
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3mol 44.8L
0.015mol V
3mol:44.8L=0.015mol:V
V=$\frac{0.015mol×44.8L}{3mol}$=0.224L=224mL,
故选B.
点评 本题考查了混合物的计算,在计算时要进行过量计算,根据不足量的为标准进行计算,注意该混合物中,硫酸中的氢离子能被硝酸根离子运用,相当于含有硝酸,为易错点,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
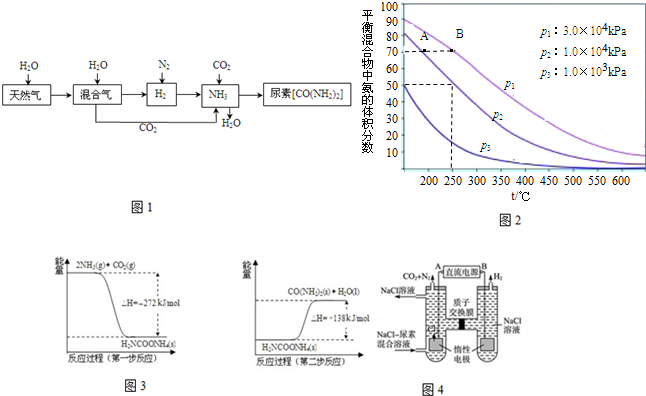
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
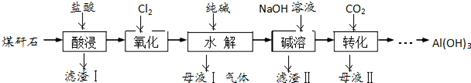
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
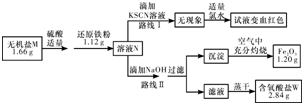
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L该溶液中含有NaOH 4.0 g | |
| B. | 给NaOH溶液通电,使NaOH发生电离 | |
| C. | NaOH的电离方程式是:NaOH═Na++OH- | |
| D. | NaOH溶液能导电,是因为溶液中有自由移动的Na+、OH-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
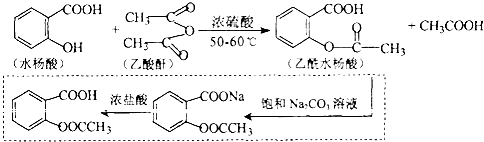


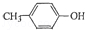 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol/L CuSO4溶液100 mL,需称量CuSO4•5H2O 1.6g | |
| B. | 40g NaOH固体溶于1 L水,所得溶液的浓度为1 mol/L | |
| C. | 200mL 0.2mol/L MgCl2溶液中Cl-的个数为0.08NA | |
| D. | 从100mL 1mol/L H2SO4溶液取出10mL溶液,此溶液的浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com