锂在原子能工业中占有十分独特的地位,被誉为“高能金属”.它推动着能源工业,尤其是电池技术的发展,无愧于“能源金属”和“推动世界前进的金属”的称号.
Ⅰ.探究金属锂的制备
工业上用硫酸与β-锂辉矿(LiAlSi
20
6和少量钙镁杂质)在250~300℃反应,生成Li
2SO
4以及硅铝化合物、MgSO
4等,请回答下列问题:
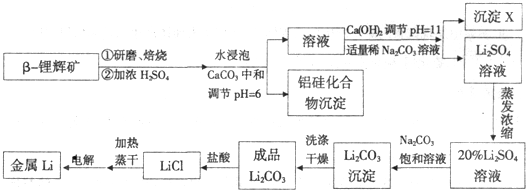
(1)LiAlSi
20
6的组成用氧化物的形式表示为
;
(2)沉淀X的主要成分是(写化学式)
;
(3)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体.试写出氢化锂遇水反应的化学方程式:
;
(4)将盐酸与Li
2CO
3,完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂.电解时产生的氯气中会混有少量氧气,原因是
.
Ⅱ探究金属锂的应用
(5)Li-SOCl
2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl
4-SOCl
2电池的总反应为:4Li+2SOCl
2═4LiCl+S+SO
2↑.请回答下列问题:
①电池的正极上发生的电极反应为
;
(6)实验室中常用NaOH溶液吸收SOCl
2,有Na
2SO
3和NaCl生成.如果把少量水滴到SOCl
2中,实验现象是出现白雾,有刺激性气味的气体生成,反应的化学方程式为
.




 阅读快车系列答案
阅读快车系列答案