
| A. | 该电池锌为负极,发生氧化反应 | |
| B. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 当该电池工作时,负极周围的pH值变大 |
分析 由电池总反应Zn+2MnO2+H2O═ZnO+2MnO(OH)可知,Zn被氧化,为原电池的负极,电极反应为Zn-2e-+2OH-═ZnO+H2O,MnO2被还原,为原电池的正极,电极反应为MnO2+H2O+e-═MnO(OH)+OH-,据此解答.
解答 解:A.由电池反应式知Zn元素化合价由0价变为+2价,则Zn失电子发生氧化反应作负极,故A正确;
B.正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O═MnO(OH)+OH-,故B正确;
C.根据电极反式Zn-2e-+2OH-═ZnO+H2O可知有0.1mol锌溶解时,电池外电路转移电子数约为0.1×2×6.02×1023=1.204×1023,故C正确;
D.负极反应为Zn-2e-+2OH-═ZnO+H2O,氢氧根离子被消耗,碱性减弱,pH值变小,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,正确判断正负极是解本题关键,难点是电极反应式的书写,题目难度不大.


科目:高中化学 来源: 题型:选择题
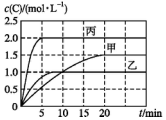 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T2℃时,丙容器比乙容器反应快的原因是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:P<S<Cl | B. | 非金属性:P>S>Cl | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 稳定性:PH3>H2S>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 手机所用的锂离子电池属于一次电池 | |
| C. | 可将反应2FeCl3+Cu=2FeCl2+CuCl2设计为原电池 | |
| D. | 铜、锌、稀硫酸原电池工作时,电子通过导线由Cu→Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
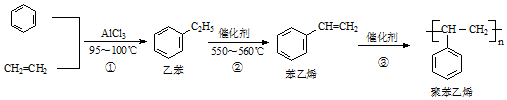
| A. | 苯乙烯的分子式为C8H8 | |
| B. | 1mol苯乙烯最多可与4molH2发生加成反应 | |
| C. | 鉴别乙苯与苯乙烯可用Br2的四氯化碳溶液 | |
| D. | 乙烯、苯和乙苯的分子中所有原子均可处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高盐酸的浓度 | B. | 搅拌反应物 | C. | 高温下酸浸 | D. | 粉碎煤矸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(C)=0.4 mol/(L•min) | D. | v(D)=0.8 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 环戊二烯中的所有原子共平面 | |
| B. | 二聚环戊二烯的分子式为C10H10 | |
| C. | 四氢二聚环戊二烯与金刚烷互为同分异构体 | |
| D. | 金刚烷的一氯代物有6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com