
分析 反应放出的热量和所用酸以及碱的量的多少有关,中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,并根据中和热的概念和实质来回答.
解答 解:反应放出的热量和所用酸以及碱的量的多少有关,若用用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用用60mL 0.50mol•L-1盐酸跟50mL 0.55mol•L-1NaOH溶液进行上述实验,测得中和热数值相等,故答案为:因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关
点评 本题主要考查了中和热的测定,注意中和热与酸、碱的物质的量无关,可以根据所学知识进行回答,难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解水:2H2O $\frac{通电}{\;}$2H2↑+O2↑ | |
| B. | 焦炭与水蒸气反应:C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO | |
| C. | 太阳光分解水:2H2O$\frac{TiO_{2}}{太阳光}$2H2↑+O2↑ | |
| D. | 天然气与水蒸气反应:CH4+H2O $\frac{高温}{\;}$CO+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48 L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4 g SO2中含有的氧原子数目为0.2NA | |
| C. | 1 L 0.1 mol•L-1 K2CO3溶液中含有的钾离子数目为0.1 NA | |
| D. | 100 mL 1.0 mol•L-1 FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某有机物通入酸性高锰酸钾溶液中,溶液褪色,则该有机物一定是不饱和烃 | |
| B. | 向甲苯和乙醇中分别加入少量水,振荡后分层的是甲苯 | |
| C. | 向乙苯和苯中分别滴加溴水,溶液褪色的是乙苯 | |
| D. | 向溴乙烷和己烷中滴加硝酸银溶液,产生浅黄色沉淀的是溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
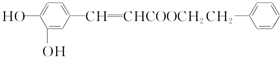
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com