
分析 (1)根据m=nM结合物质的微粒构成情况进行计算;
(2)1.5mol CO2中含有的氧原子物质的量是3mol,微粒的数目之比等于微粒的物质的量之比;
(3)R原子的质量数为A,则其摩尔质量为Ag/mol,根据n=$\frac{m}{M}$计算原子的物质的量;质量数=质子数+中子数,再由阴离子R2-核外有N个中子,则质子数为A-N,阴离子中:质子数+所带电荷数=核外电子数,该离子的核外电子总数为A-N+2,以此解答该题.
解答 解:(1)111g CaCl2的物质的量n=$\frac{111g}{111g/mol}$=1mol,含有钙离子的物质的量是1mol,氯离子的物质的量是2mol,总离子数是3NA,故答案为:1;2;3NA;
(2)1.5mol CO2中含有的氧原子物质的量是3mol,微粒的数目之比等于微粒的物质的量之比,所以和3molH2O中含有的氧原子数,故答案为:3;
(3)R原子的质量数为A,则其摩尔质量为Ag/mol,根据n=$\frac{m}{M}$计算原子的物质的量;质量数=质子数+中子数,再由阴离子R2-核外有N个中子,则质子数为A-N,阴离子中:质子数+所带电荷数=核外电子数,该离子的核外电子总数为A-N+2,所以mg Rn-电子的物质的量为:$\frac{m}{A}$mol×(A-N+2)=$\frac{m(A-N+2)}{A}$mol,故答案为:A-N+2;$\frac{m(A-N+2)}{A}$mol.
点评 本题考查学生利用原子构成的简单计算,题目难度不大,明确原子的物质的量的计算是解答本题的关键,注意电子的质量可忽略,质量数近似等于相对原子质量.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:解答题
 实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:
图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性,可用热的纯碱溶液除去金属表面的油污 | |
| B. | 明矾溶于水可形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| C. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| D. | 氢氧化铁的溶解度比氢氧化铜的小得多,可向硫酸铜溶液中加入氢氧化铁除去混有的Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 | 离子方程式 |
| 1. | NO | NO2 | |||
| 2. | Fe粉 | Al粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
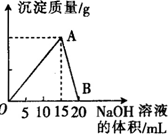 向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物都是金属氧化物 | |
| B. | 凡是酸性氧化物都能和水反应生成相应的酸 | |
| C. | 单质含有一种元素,有一种元素形成的物质就是单质 | |
| D. | 凡在水中电离出H+的物质就是酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com