
����Ŀ����V1 mL 1.0mol/L HCl��Һ��V2mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ(ʵ����ʼ�ձ���V1+V2=50mL)������������ȷ����(�� ��)
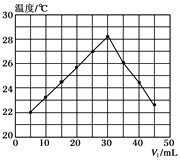
A. ����ʵ��ʱ�����¶�Ϊ22��
B. NaOH��Һ��Ũ��ԼΪ1.5mol/L
C. ��ʵ������Ҫʹ�û��β����������ˮƽ��������ת������
D. ��ʵ�������ͬ���ʵ������������ƹ���Ͷ�������вⶨ�к���
���𰸡�B
��������A����ʵ�鿪ʼ�¶���22�棬��A����B��ǡ�÷�Ӧʱ�μӷ�Ӧ��������Һ�������30mL����V1+V2=50Ml��֪�����ĵ�����������Һ�����Ϊ20mL����ǡ�÷�Ӧʱ����������Һ�����ʵ����ʵ�����n��
HCl+NaOH=NaCl+H 2O
11
1.0molL-1��0.03L n
��n=1.0molL-1��0.03L=0.03mol������Ũ���ǣ� ![]() =1.5mol/L����B��ȷ��C����ʵ������Ҫʹ�û��β�������������·�������ת�����裬��C����D. ��ʵ�鲻������ͬ���ʵ������������ƹ���Ͷ�������вⶨ�к��ȣ�������NaOH�ܽ���ȣ�ʹ�òⶨ��ֵƫ�ߣ���D����ΪB��
=1.5mol/L����B��ȷ��C����ʵ������Ҫʹ�û��β�������������·�������ת�����裬��C����D. ��ʵ�鲻������ͬ���ʵ������������ƹ���Ͷ�������вⶨ�к��ȣ�������NaOH�ܽ���ȣ�ʹ�òⶨ��ֵƫ�ߣ���D����ΪB��


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�1 molX��n mol Y���ݻ�Ϊ2L���ܱ������з������·�Ӧ��X(g)+Y(g)![]() 2Z(g)+M(s)��5min��ﵽƽ�⣬��ʱ����0.2 mol Z������˵����ȷ����
2Z(g)+M(s)��5min��ﵽƽ�⣬��ʱ����0.2 mol Z������˵����ȷ����
A����������ѹ��ʱ�����淴Ӧ���ʾ�����
B��5 min��ƽ����Ӧ����v(X)=0.02 mol/(L��min)
C����ƽ������ϵ�м���l molM(s)��ƽ�����淴Ӧ�����ƶ�
D�������������������ٷ����仯ʱ��˵����Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��Ϊ����������Ԫ�أ���ԭ����������������֪WԪ�ص�ԭ���γɵ�������һ�����ӣ�X��Y��Ԫ�����ڱ��д������ڵ�λ�ã����ǵĵ����ڳ����¾�Ϊ��ɫ���壻ZΪͬ������ԭ�Ӱ뾶����Ԫ�ء������й�˵����ȷ����
A. ����Ԫ�ؾ�Ϊ�ǽ���Ԫ��
B. W��X��Y�γɵ�����ӵķе㣺X>Y
C. Y��Z�γɵĻ�������ֻ�����Ӽ�
D. W��Y��Z�γɵĻ�����ĵ���ʽΪ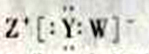
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��¡�һ����������£���˵�����з�Ӧ�ﵽƽ��״̬����
A����Ӧ2SO2(g)+O2(g)![]() 2SO3(g) �����ڵ��ܶȲ���ʱ��仯
2SO3(g) �����ڵ��ܶȲ���ʱ��仯
B����ӦA2(g)+B2(g)![]() 2AB(g)������A2������������AB�����������
2AB(g)������A2������������AB�����������
C����ӦN2+3H2![]() 2NH3����������ƽ����Է�����������ʱ��仯
2NH3����������ƽ����Է�����������ʱ��仯
D����Ӧ4A(s)+3B(g)![]() 2C(g)+D(g)������������ѹǿ����ʱ��仯
2C(g)+D(g)������������ѹǿ����ʱ��仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������Na��K�ֱ�Ͷ��������ͬŨ�ȡ�ͬ�����ϡ�����У�����ͬ�����²��������������ʱ��仯��������ͼ��a��b��ʾ��������˵���в���ȷ����

A. ����a��Ӧ�ķ�Ӧʹ���˴���
B. Ͷ���Na��K���ʵ������
C. ����a����K�ķ�Ӧ������b����Na�ķ�Ӧ
D. ����Ӧ�з�Ӧ���ʲ�ͬ����Ҫԭ���Ƿ�Ӧ�����������ʲ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦH2(g)+Cl2(g)�T2HCl(g) �ķ������������仯������ʾ��
![]()
����˵���������
A��H��H����Cl��Cl���ȶ�
B����H=��184.5 kJmol��1
C������Ӧ��ܱ��淴Ӧ��ܸ�
D������ͬ�����£�1mol H2(g)��1mol Cl2(g)�ֱ��ڵ�ȼ���������·�Ӧ����2mol HCl(g)�����»ָ���ԭ����״̬ʱ��H��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȿ������������������ϩ���ֿ���������ȥ�����л��е�������ϩ�IJ��������ǣ� ��
A.�������ͨ��ʢˮ��ϴ��ƿ
B.�������ͨ��װ�й�����ˮ��ϴ��ƿ
C.����������H2���
D.�������ͨ������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ2SO2+O2![]() 2SO3�������ж���ȷ����
2SO3�������ж���ȷ����
A. 2 mol SO2��5 mol O2��ַ�Ӧ������2 mol SO3
B. 2 mol SO2��1mol O2�ﵽ��ѧƽ��ʱSO2��O2��SO3�ķ�����֮��һ��Ϊ2��1��2
C. �ﵽ��ѧƽ��ʱSO2���������ʱض�����O2���������ʵ�2��
D. �������ʵ�Ũ�����ʱ��˵����Ӧ�ﵽ�˻�ѧƽ�⡣
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com