
����Ŀ��G Ϊ�������������һ����Ȼ���ϣ���Ȼ������ϵͣ�����A �ɺϳ��������������·�����£� 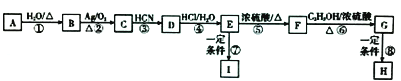
��֪����A ���ڵ�ȡ��������������Է�������Ϊ104��
��  ������������Ľṹ��ʽΪ
������������Ľṹ��ʽΪ 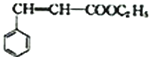
��I��H ��Ϊ�߷��ӻ����
��Ҫ��ش��������⣺
��1��A �Ľṹ��ʽΪ��C �Ļ�ѧ����Ϊ ��
��2����C ����D �ķ�Ӧ����Ϊ����F ����G �Ļ�ѧ����ʽΪ ��
��3����Ӧ�ߢ����ɸ߷��ӻ����ﷴӦԭ�������ͬ������ͬ��������H ��ƽ���� �Է�������Ϊ10630������ƽ���ۺ϶�ԼΪ�����ţ���
a.56 b.58 c.60 d.62
��4��K ����Է���������G �Ĵ�2��K ��ͬ���칹����ͬʱ�������������Ĺ�����
�����������칹����
���ܷ���������Ӧ�� �ڼ����Ȼ�����Һ����ɫ�� �۱�������������λ��ȡ������
���к˴Ź���������ʾΪ6 ��壬�ҷ��������Ϊ9��1��1��1��1��1 ����
��д�ṹ��ʽ����
��5�����������й���Ϣ�ͺϳ�·�߱�ʾ��ʽ��д��C2H5OH ��ԭ�Ϻϳ����� �� ![]() ����·�ߣ������Լ���ѡ�� ��
����·�ߣ������Լ���ѡ�� ��
���𰸡�
��1��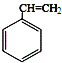 ������ȩ
������ȩ
��2���ӳɷ�Ӧ��![]() +CH3CH2OH
+CH3CH2OH ![]()
 +H2O
+H2O
��3������ͬ��c
��4��13��
��5��
���������⣺A����Է�������Ϊ104�ķ�������������̼ԭ�������ĿΪ ![]() =8��8����A�ķ���ʽΪC8H8 �� A�Ľṹ��ʽΪ
=8��8����A�ķ���ʽΪC8H8 �� A�Ľṹ��ʽΪ 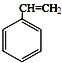 �� ��Ӧ�٣�A��ˮ�����ӳɷ�Ӧ
�� ��Ӧ�٣�A��ˮ�����ӳɷ�Ӧ  +H2O
+H2O ![]()
![]() ����Ӧ�ڣ�B����������Ӧ
����Ӧ�ڣ�B����������Ӧ ![]() ����Ӧ�ۣ�C�����ӳɷ�Ӧ
����Ӧ�ۣ�C�����ӳɷ�Ӧ ![]()
![]()
 ��Ӧ�ܣ�Dˮ��
��Ӧ�ܣ�Dˮ��  +H2O
+H2O ![]()
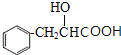 ��Ӧ�ݣ�E��Ũ���������·�����ȥ��Ӧ
��Ӧ�ݣ�E��Ũ���������·�����ȥ��Ӧ 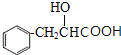
![]()
![]() +H2O��Ӧ�ޣ�F���Ҵ�����������Ӧ
+H2O��Ӧ�ޣ�F���Ҵ�����������Ӧ ![]() +CH3CH2OH
+CH3CH2OH ![]()
 +H2O��Ӧ�ߣ�Ϊ���۷�Ӧ
+H2O��Ӧ�ߣ�Ϊ���۷�Ӧ 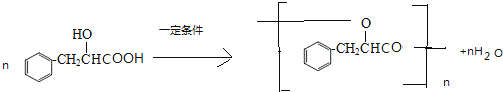 ��Ӧ�ࣺΪ�Ӿ۷�Ӧ
��Ӧ�ࣺΪ�Ӿ۷�Ӧ  ��1��������������֪��A�ķ���ʽΪC8H8 �� �ṹ��ʽΪ
��1��������������֪��A�ķ���ʽΪC8H8 �� �ṹ��ʽΪ  ��B����������Ӧ�õ�C
��B����������Ӧ�õ�C ![]() ��CΪ
��CΪ ![]() ����ѧ����Ϊ����ȩ�����Դ��ǣ�
����ѧ����Ϊ����ȩ�����Դ��ǣ�  ������ȩ��2����Ӧ�ۣ�C�����ӳɷ�Ӧ�õ�D
������ȩ��2����Ӧ�ۣ�C�����ӳɷ�Ӧ�õ�D ![]()
![]()
 ����F ����G Ϊ��ʹ���������Ӧ�������ǻ��������⣬��ӦΪ��
����F ����G Ϊ��ʹ���������Ӧ�������ǻ��������⣬��ӦΪ�� ![]() +CH3CH2OH
+CH3CH2OH ![]()
 +H2O�����Դ��ǣ��ӳɷ�Ӧ��
+H2O�����Դ��ǣ��ӳɷ�Ӧ�� ![]() +CH3CH2OH
+CH3CH2OH ![]()
 +H2O��3����Ӧ�ߣ�Ϊ���۷�Ӧ
+H2O��3����Ӧ�ߣ�Ϊ���۷�Ӧ  ��Ӧ�ࣺΪ�Ӿ۷�Ӧ
��Ӧ�ࣺΪ�Ӿ۷�Ӧ  ���Է�Ӧ�ߢ����ɸ߷��ӻ����ﷴӦԭ������ͬ��GΪ
���Է�Ӧ�ߢ����ɸ߷��ӻ����ﷴӦԭ������ͬ��GΪ  ��ʽ��Ϊ176g/mol����H ��ƽ���� �Է�������Ϊ10630������ƽ���ۺ϶�ԼΪ
��ʽ��Ϊ176g/mol����H ��ƽ���� �Է�������Ϊ10630������ƽ���ۺ϶�ԼΪ ![]() ��60����C���ϣ�
��60����C���ϣ�
���Դ��ǣ�����ͬ��c��
4��K ����Է���������G �Ĵ�2��Ϊ ![]() ����ͬ���칹��������FeCl3��Һ������ɫ��Ӧ���ܷ���������Ӧ�����з��ǻ���ȩ��������Ϊ��OH����CH2CHOʱ�����ڡ��䡢��3��λ�ã�����Ϊ��OH����CHO����CH3ʱ������OH����CHO����ʱ����CH3��4��λ�ã�����OH����CHO���ʱ����CH3��4��λ�ã�����OH����CHO���ʱ����CH3��2��λ�ã��ʷ���������ͬ���칹���У�3+4+4+2=13�֣����к˴Ź���������ʾΪ6 ��壬�ҷ��������Ϊ9��1��1��1��1��1 ����
����ͬ���칹��������FeCl3��Һ������ɫ��Ӧ���ܷ���������Ӧ�����з��ǻ���ȩ��������Ϊ��OH����CH2CHOʱ�����ڡ��䡢��3��λ�ã�����Ϊ��OH����CHO����CH3ʱ������OH����CHO����ʱ����CH3��4��λ�ã�����OH����CHO���ʱ����CH3��4��λ�ã�����OH����CHO���ʱ����CH3��2��λ�ã��ʷ���������ͬ���칹���У�3+4+4+2=13�֣����к˴Ź���������ʾΪ6 ��壬�ҷ��������Ϊ9��1��1��1��1��1 ����  �����Դ��ǣ�13��
�����Դ��ǣ�13��  ��5��CH3CH2OH������������CH3CHO��CH3CHO��HCN�����ӳɷ�Ӧ����CH3CH��OH��CN�������ʷ���ˮ�ⷴӦ����CH3CH��OH��COOH����ϳ�·��Ϊ
��5��CH3CH2OH������������CH3CHO��CH3CHO��HCN�����ӳɷ�Ӧ����CH3CH��OH��CN�������ʷ���ˮ�ⷴӦ����CH3CH��OH��COOH����ϳ�·��Ϊ  �����Դ��ǣ�
�����Դ��ǣ�  ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع�������У���ȷ����
A.��ҵ��ͨ����SiO2Ϊԭ�ϣ������������䷴Ӧ�Ʊ����ʹ�
B.���ǹ��ɿ������ʯ����ҪԪ�أ����ڵؿ��еĺ��������е�Ԫ���оӵ�һ λ
C.��Ļ�ѧ���ʲ����ã�����Ȼ���п���������̬����
D.���ڵ��ӹ�ҵ�У�����Ҫ�İ뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 g��1.17 g NaCl��0.84 g NaF����Һ�У��μӹ�����AgNO3��Һ�����ã����ˣ�ϴ�ӣ����صõ�2.87 g���壬�ɴ˿��Եó�����ȷ������(����)
A. ������ֻ��һ���ֲμӷ�Ӧ
B. ������ֻ��һ���ֲμӷ�Ӧ
C. ��������AgNO3����Һ����������
D. ������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��һ�־��й���ζ�ĺϳ����ϣ���ͼΪ�ϳ�X��ij�����̣� 
��֪���� ![]() �������ձ�����Ϊ��COOH��
�������ձ�����Ϊ��COOH��
��D�IJ���������������һ�����ҵ�ʯ�ͻ���ˮƽ��
�ش��������⣺
��1��D��C�����й����ŵ����Ʒֱ�Ϊ �� E�Ľṹ��ʽ�� ��
��2��D��E�ķ�Ӧ����Ϊ ��
��3������A��B��C��D��E��X���������У���Ϊͬϵ�����������ĸ���ţ���
��4����ӦC+E��X�Ļ�ѧ����ʽΪ ��
��5����ӦA��B�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڱ���ͬ��Ԫ�ص������ԣ���Ԥ��Ԫ�ص����ʣ�
��1��PԪ�صĻ�̬ԭ������δ�ɶԵ��ӣ����ķ���ʽΪP4 �� ��ṹ��ͼ1��ʾ�� 
��ѧ��Ŀǰ�ϳ���N4���ӣ�Nԭ�ӵ��ӻ���������� �� N��N���ļ���Ϊ��N4�ֽ���ܲ���N2���ͷų������������Ʋ�����;Ϊ ��
��2��N��P��Asԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ ��
��3��������������Ľṹ��ͼ2��ʾ��
�þ����У�Bԭ�������Nԭ�ӵ���϶����ռ�ݴ����϶�ı���Ϊ ����ٷ�������
��4��N��As��ͬ��Ԫ�أ�B��Ga��ͬ��Ԫ�أ������黯�ؾ�����������������ṹ���ƣ����־������۵�ϸߵ����������黯�ؾ���ľ����߳�Ϊa pm�������ܶ�Ϊgcm��3 ���ú�a��ʽ�ӱ�ʾ����NAΪ�����ӵ�������ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع����β�Ʒ��˵������ȷ���ǣ� ��
A. ˮ�����ˮӲ��B. ������ԭ���Ǵ��ʯ��ʯ��ʯӢ
C. �����й̶����۷е�D. �մ�����������ʹ�õĹ����β�Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ʒ������Ʒ�ڿ����в��ױ���ʴ��ԭ���ǣ� ��
A. ���Ľ����Ա�����B. ���ڿ��������������γ�һ�����ܵ�����Ĥ
C. �����ܶȱ������ܶ�СD. ������������������ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1mol/L�Ķ�Ԫ��H2A��Һ�У���Һ��ϵ���ܴ��ڵĺ�A���ӣ�H2A��HA����A2������ռ���ʵ���������pH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��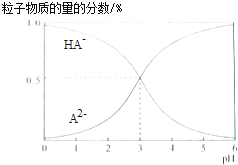
A.H2A�ĵ��뷽��ʽΪ��H2AH++HA��
B.pH=5ʱ����NaHA��Na2A�Ļ����Һ�У�c��HA������c��A2����=1��100
C.�����ʵ���Ũ�ȵ�NaHA��Na2A��Һ�������ϣ�����Ũ�ȴ�С��ϵΪc��Na+����c��HA������c��A2����
D.Na2A��Һ�ش���c��OH����=c��H+��+c��HA����+2c��H2A����������Ũ�Ⱦ�����0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ��������ȷ���ǣ� ��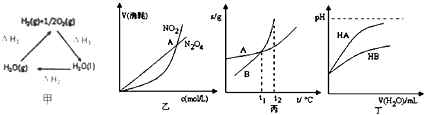
A.����H1=������H2+��H3��
B.�ұ�ʾ���º��������·����Ŀ��淴Ӧ2NO2��g���TN2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
C.����ʾA,B�����ʵ��ܽ�����¶ȱ仯�������tl��ʱA��B�ı�����Һ�ֱ�������t2��ʱ�����ʵ���������B��A
D.����ʾ�����£�ϡ��HA,HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����NaA��Һ��pH���ڵ����ʵ���Ũ�ȵ�NaB��Һ��pH
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com