铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO
3大量地用于电镀工业中.
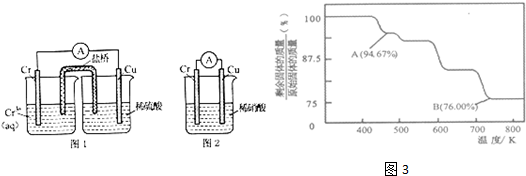
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体.根据上述现象试推测金属铬的两个重要化学性质,由图 1 知
、由图 2 知
.
(2)CrO
3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO
3被还原成绿色的硫酸铬[Cr
2(SO
4)
3].则该反应的化学方程式为:
.
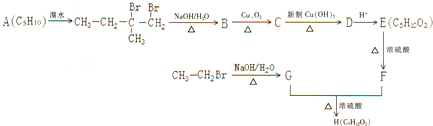
(3)CrO
3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如3图所示.
①A 点时剩余固体的成分是
(填化学式).
②从开始加热到 750K 时总反应方程式为
.
(4)CrO
3和 K
2Cr
2O
7均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe
2+和Cr
2O
72-发生反应,生成的Fe
3+和Cr
3+在阴极区与OH
-结合生成 Fe(OH)
3 和Cr(OH)
3沉淀除去[已知 K
spFe(OH)
3=4.0×10
-38,K
spCr(OH)
3=6.0×10
-31].
①电解过程中 NaCI 的作用是
.
②已知电解后的溶液中c(Fe
3+)为2.0×10
-13 mol?L
-1,则溶液中c(Cr
3+)为_
_ mol?L
-1.




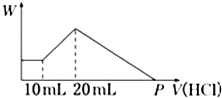 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示: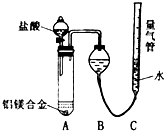 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.