
浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述错误的是( )

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A.含有Y元素的可溶性盐溶于水一般都可以破坏水的电离平衡
B.Z的最高价氧化物能与水反应生成相应的酸
C.X、Y、Z原子半径由小到大的顺序是Y>Z>X
D.常温下,0.1 mol·L-1 W的气态氢化物的水溶液的pH>1
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第三次模拟考试理综化学试卷(解析版) 题型:填空题
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略).
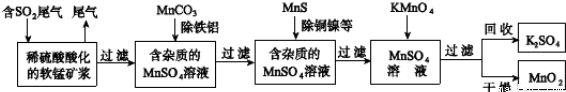
请回答下列问题:
(3)已知:25℃、101kPa时,
Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是____________________________________。
(2)用离子方程式表示用MnCO3除去Al3+和Fe3+的原理(任选其一即可):_______________。
(3)用离子方程式表示用MnS除去Cu2+和Ni2+的原理(任选其一即可):___________________________。
(4)MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式是__________。
(5)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是__________。
(6)假设脱硫的SO2只与软锰矿浆中MnO2反应.按照图示流程,将am3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为ckg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2____________kg。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中测试化学试卷(解析版) 题型:选择题
质量分数不等的两种硫酸溶液等质量混合时,其质量分数为a %,而等体积混合后的质量分数为b %;质量分数不等的两种氨水溶液等质量混合时,其质量分数为a %,,而等体积混合后的质量分数为c %。则a、b、c的大小关系正确的是: ( )
A.a>b>c B. b>a>c C. c>a>b D.a>c>b
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省分校高三上学期12月月考理综化学试卷(解析版) 题型:选择题
26g锌和含63gHNO3的稀硝酸正好完全反应,生成的还原产物的相对分子质量可能是( )
A. 80 B. 30 C. 46 D. 28
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路第一中学高一上段考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,11.2 L氯气所含的原子数目为NA
B.标准状况下,1.12 L O2 和1.12 L CO2均含有0.1NA氧原子
C.标准状况下,22.4 L空气含有NA个单质分子
D.标准状况下,22.4 L H2O含有NA个水分子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路第一中学高二上段考理化学卷(解析版) 题型:填空题
I.(1)H3PO2是一元中强酸,写出其电离方程式_________________________________。
(2)③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显______(填“酸性”、“中性”或“碱性”)。
II.现有pH=2的醋酸甲和pH=2的盐酸乙:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;若加入少量的冰醋酸,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液混合,溶液的pH=___ ___,若两溶液不等体积混合,则
pH___ ___。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)________ V(乙) ( 填“>”、“<”或“=”)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)________ c(CH3COO-) ( 填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中理化学试卷(解析版) 题型:选择题
已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解的机理为:
H2O2+ I- → H2O+IO- 慢 H2O2+ IO-→ H2O+O2+ I- 快
下列有关该反应的说法正确的是
A.反应速率与I-浓度有关 B.IO-也是该反应的催化剂
C.反应活化能等于98kJ/mol D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com