
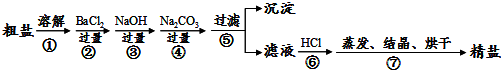
分析 实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,加入过量的氯化钡,可以将硫酸根离子除去,但是会引入钡离子杂质离子,加入过量氢氧化钠溶液的目的是除去氯化镁,加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠,
(1)根据分析可知,碳酸钠必须放在氯化钡溶液后;
(2)根据溶解、过滤和蒸发的操作方法分析;蒸发时用玻璃杯搅拌,使溶液受热均匀;
(3)步骤⑤后得到的沉淀有碳酸钡、碳酸钙、硫酸钡、氢氧化镁;
(4)根据n=$\frac{m}{M}$计算出氯化银的物质的量,然后根据反应方程式计算出氯化钠的物质的量,再根据m=nM计算出氯化钠的质量,最后计算出样品中氯化钠的质量分数.
解答 解:实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,加入过量的氯化钡,可以将硫酸根离子除去,但是会引入钡离子杂质离子,加入过量氢氧化钠溶液的目的是除去氯化镁,加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠,
(1)根据分析可知,BaCl2、NaOH、Na2CO3的加入顺序,必须保证Na2CO3放在BaCl2之后,
故答案为:Na2CO3;BaCl2;
(2)溶解、过滤、蒸发过程中都使用到的玻璃仪器是玻璃杯,蒸发时,通过玻璃棒的搅拌,使溶液受热均匀,防止受热不均导致液体飞溅,
故答案为:玻璃杯;搅拌,防止受热不均导致液体飞溅;
(3)经过⑤过滤之后得到的沉淀的成分有:Mg(OH)2、BaSO4、CaCO3、BaCO3,
故答案为:Mg(OH)2、BaSO4、CaCO3、BaCO3;
(4)制得的精盐中不小心混入了硝酸钾晶体,用电子天平称取8.00g样品溶于水,向溶液中加入足量硝酸银溶液(发生如下反应AgNO3+NaCl↓+NaNO3),将产生的沉淀过滤、洗涤、干燥,并称得其质量为14.35g,得到沉淀为AgCl,其物质的量为:$\frac{14.35g}{143.5g/mol}$=0.1mol,根据反应AgNO3+NaCl↓+NaNO3可知样品中含有NaCl的物质的量为0.1mol,含有NaCl的质量为:58.5g/mol×0.1mol=5.85g,
所以该样品中氯化钠的质量分数为:$\frac{5.85g}{8.00g}$×100%=73.125%,
故答案为:73.125%.
点评 本题考查了物质分离与提纯方法,题目难度中等,涉及常见化学实验基本操作方法的综合应用、粗盐提纯、质量分数的计算等知识,明确加入试剂的先后顺序为解答关键,试题培养了学生的分析能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:计算题
| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 13 |
| ② | 22.00 | 18.00 | 12 |
| ③ | 22.00 | 22.00 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| C. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
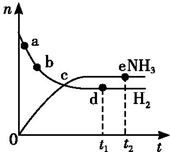 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )| A. | c点表示NH3生成速率与NH3分解速率相等 | |
| B. | c点和e点H2的转化率相等 | |
| C. | 平衡后再升高温度,不利于氨的合成 | |
| D. | d点时:n(H2):n(NH3)=3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 物质发生化学反应都伴随着能量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com