
 丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题
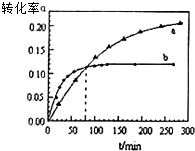
丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题分析 (1)分析图象题时注意曲线的变化,温度越高,化学反应速率越大,达到平衡时的时间就越少,曲线的斜率就越大;根据图象可以看出温度越高CH3COCH3转化的越少,说明升高温度平衡向逆反应方向进行,CH3COCH3的转化率反而降低,分析图象,当反应进行到80min时a、b曲线对应的转化率相同,这说明此时生成的CH3COCH2COH(CH3)2一样多;
(2)利用化学平衡三段式计算出平衡时各物质的浓度,根据平衡常数的定义进行计算;
(3)该反应的正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小;
2分子的CH3COCH3(aq)生成1分子的CH3COCH2COH(CH3)2(aq),故△S<0;
△G=△H-T△S;△H<0,△S<0,要使△G<0,故在低温时有利于该反应自发进行;
(4)温度不变,则平衡常数不变,利用平衡常数分析起始浓度与转化率的关系.
解答 解:(1)2CH3COCH3(aq)$\frac{\underline{\;催化剂\;}}{\;}$CH3COCH2COH(CH3)2(aq).
A.温度越高,反应速率就越快,到达平衡的时间就越短,由图象可看出曲线b首先到达平衡,所以曲线b表示的是60℃时的α-t曲线,故A错误;
B.温度越高,反应速率就越快,到达平衡的时间就越短,由图象可看出曲线b首先到达平衡,所以曲线b表示的是60℃时的α-t曲线;升高温度,转化率减小,平衡逆向移动,故该反应的正反应为放热反应,故B正确;
C.根据图象温度越高CH3COCH3转化的越少,说明升高温度平衡向逆反应方向进行,故C错误;
D.无气体参加的反应,增大压强对平衡不产生影响,故D错误;
E.80min时,生成的CH3COCH2COH(CH3)2一样多,故从0到80min,CH3COCH2COH(CH3)2的$\frac{△n(40℃)}{△n(60℃)}$=1,故E正确;
故选AE;
(2)当丙酮的起始浓度为0.10mol•L-1时,实验测得20℃时的平衡转化率为60%;
2CH3COCH3(aq)$\frac{\underline{\;催化剂\;}}{\;}$CH3COCH2COH(CH3)2(aq)
开始(mol/L):0.1 0
变化(mol/L):0.06 0.03
平衡(mol/L):0.04 0.03
平衡常数k=$\frac{0.03}{0.04×0.04}$=18.75,
故答案为:18.75;
(3)若该反应在40℃和60℃时的平衡常数分别为K1和K2,该反应的正反应为放热反应,升高温度,平衡逆向移动,故则K1>K2;2分子的CH3COCH3(aq)生成1分子的CH3COCH2COH(CH3)2(aq),故△S<0;△G=△H-T△S;△H<0,△S<0,要使△G<0,故在低温时有利于该反应自发进行;
故答案为:>;<;较低;
(4)由三段法计算可知,K=$\frac{a}{2{C}_{0}(1-a)^{2}}$,温度不变,则K不变,则增大丙酮的起始浓度,为保证K不变,则转化率a应增大;
故答案为:增大.
点评 本题考查转化率随温度变化的图象题,难度较大.做题时注意观察曲线的变化趋势,以及温度对化学反应速率的影响,本题的关键是根据图象正确判断反应是吸热还是放热.


科目:高中化学 来源: 题型:选择题
| A. | CuFeS2仅作还原剂,硫元素被氧化 | B. | SO2既是氧化产物又是还原产物 | ||
| C. | FeS既是氧化产物又是还原产物 | D. | 1molO2反应氧化2molCuFeS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32% | B. | 24.2% | C. | 22.2% | D. | 16.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O→SO42-+2H++2Fe2+ | B. | I2+SO2+2H2O→H2SO4+2HI | ||
| C. | H2O2+2H++SO42-→SO2↑+O2↑+2H2O | D. | 2Fe3++2I-→2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,常用于汽水、糖果的添加剂.
,常用于汽水、糖果的添加剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g冰的晶体中含有氢键的数目为2NA | |
| B. | 11.2 L丙烷(标准状况)中含有σ键的数目为5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中舍有氧原子的数目为2NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 金属(粉末状) (mol) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 5 mol•L-1 硝酸 10mL | 60 |
| B | Mg,0.1 | 3 mol•L-1 盐酸 10mL | 60 |
| C | Fe,0.1 | 3 mol•L-1 盐酸 100mL | 60 |
| D | Mg,0.1 | 2 mol•L-1 硫酸 5mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的硬度大于铝 | B. | 镁的熔沸点高于钙 | ||
| C. | 镁的硬度大于钾 | D. | 钙的熔沸点高于钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com