
| A. | 升高温度 | B. | 降低压强 | C. | 及时分离出Z | D. | 使用催化剂 |
科目:高中化学 来源: 题型:选择题
| A. | 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL | |
| B. | 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50mL | |
| C. | 用10mL量筒量取8.25mL盐酸 | |
| D. | 用普通pH试纸测得某溶液pH为3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
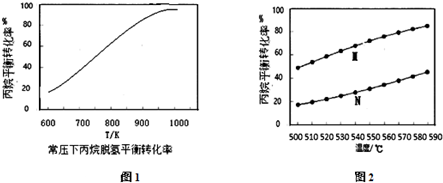
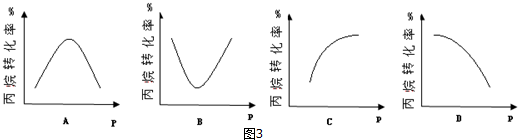
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
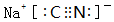 .
.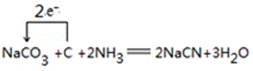 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
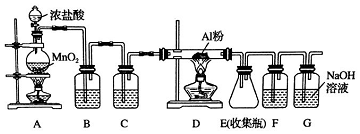
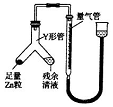
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com