
分析 (1)钠和水反应生成氢氧化钠和氢气;根据过氧化钠能够与二氧化碳生成氧气角度分析其用途;
(2)氯化铝和氢氧化钠溶液反应,先生成氢氧化铝沉淀,氢氧化铝再和氢氧化钠溶液反应生成偏铝酸钠;
(3)根据转移电子守恒计算;
(4)铁离子能够与铜反应生成铜离子和亚铁离子,据此可用氯化铁溶液腐蚀电路板;亚铁离子具有还原性,能够使酸性高锰酸钾溶液褪色,据此可具有亚铁离子.
解答 解:(1)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2Na++2OH-+H2↑;过氧化钠能够与二氧化碳反应生成氧气,所以过氧化钠可以作潜水艇供氧剂、呼吸面具来源等,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;潜水艇供氧剂、呼吸面具来源;
(2)AlCl3中加入NaOH先生成Al(OH)3,发生Al3++3OH-═Al(OH)3↓,Al(OH)3具有两性,继续加入NaOH溶液则发生Al(OH)3+OH-═AlO2-+2H2O,可观察到沉淀溶解,
故答案为:溶液先变浑浊后澄清解;Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-═AlO2-+2H2O;
(3)铝分别和足量的氢氧化钠和稀硫酸反应,如果生成相同条件下等量的氢气,这两个反应中都是铝失电子,由转移电子守恒知,需要铝的物质的量之比为1:1,
故答案为:1:1;
(4)三价铁离子氧化性强于铜离子,能够与铜反应生成铜离子和三价铁离子,反应的两种方程式为:2Fe3++Cu=Cu2++2Fe2+;
亚铁离子具有还原性,可以用酸性高锰酸钾溶液检验检验Fe3+中是否混有Fe2+,
故答案为:Cu+2Fe3+=2Fe2++Cu2+,酸性高锰酸钾溶液.
点评 本题考查了常见金属单质及化合物性质的综合应用,题目难度中等,明确常见金属单质及其化合物性质为解答关键,注意掌握离子方程式的书写规则、常见离子的检验方法,能够利用电子守恒分析、计算氧化还原反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
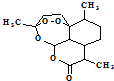 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).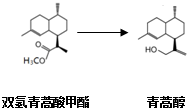
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若晶体熔融状态下能导电,该晶体一定是离子晶体 | |
| B. | 若晶体熔化时化学键断裂,该晶体一定是原子晶体 | |
| C. | 若晶体中含有非极性分子,该晶体可能有较低的熔沸点 | |
| D. | 若晶体中含有极性共价键,该晶体不可能有很高的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=20 | B. | x=40 | C. | 20<x<40 | D. | x>40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
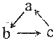 的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | NO | Fe | Al |
| b | CuCl2 | NO2 | FeCl3 | Al(OH)3 |
| c | Cu | HNO3 | FeCl2 | AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
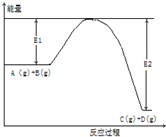 反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
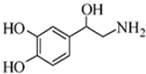
| A. | 该有机物的分子式是C8H10NO3 | |
| B. | 1mol该有机物最多能与2molBr2发生反应 | |
| C. | 该有机物不能与Na2CO3溶液反应 | |
| D. | 该有机物既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com