
| A. | ② | B. | ②④ | C. | ①③④ | D. | ③④ |
分析 淀粉水解生成葡萄糖,根据葡萄糖与新制Cu(OH)2悬浊液发生反应需在碱性的条件下进行,结合实验操作步骤中的注意点选择先后顺序,即可进行解答.
解答 解:淀粉水解的实验步骤为:取少量其水解产物中加入3~5滴稀硫酸,将混合液煮沸几分钟;
检验其水解产物的实验步骤为:因还原性糖葡萄糖与新制Cu(OH)2悬浊液或银氨溶液发生氧化反应,须在碱性条件下,而此时溶液中有硫酸呈酸性,所以,在冷却后的溶液中加入新制Cu(OH)2悬浊液溶液前,加碱中和至碱性所以选①;碘遇淀粉变蓝色,溶液成蓝色说明未完全水解,
所以该实验中必须使用的是:①③④,
故选C.
点评 本题考查了淀粉的水解及其产物葡萄糖与新制Cu(OH)2悬浊液作用的实验,掌握葡萄糖与新制Cu(OH)2悬浊液反应的条件是解答的关键,注意根据操作的要点选择操作顺序,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水和氯化亚铁溶液 | B. | 铁屑和氯化铜溶液 | ||
| C. | 铁屑和过量稀硫酸 | D. | 过量铁屑和氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl溶液腐蚀印刷电路板Fe3++Cu═Fe2++Cu2+ | |
| B. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| C. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
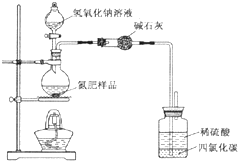 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
样品质量/g | 7.750 | 15.50 | 23.25 |
氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砂滤是利用过滤原理除去水中较大的固体颗粒 | |
| B. | 臭氧可以消毒杀菌是因为臭氧有强氧化性 | |
| C. | 游泳池水中的臭氧浓度越大越好 | |
| D. | 活性炭可以吸附水中悬浮的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
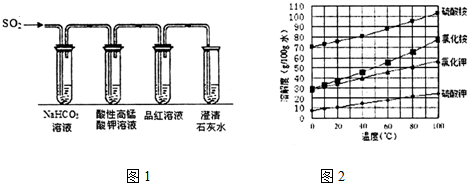
 硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.
硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.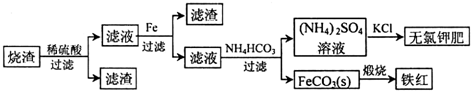
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com