
 如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )| A. | 13、7、1 | B. | 12、7、2 | C. | 1、7、13 | D. | 7、13、1 |
分析 由离子放电顺序可知,电解时,I、Ⅱ、Ⅲ中溶液电极方程式分别为2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑、2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,由铜的质量计算转移电子的物质的量,进而计算各溶液的pH.
解答 解:n(Cu)=$\frac{0.32g}{64g/mol}$=0.005mol,由电极反应Cu2++2e-=Cu可知转移电子为0.01mol,
电解时,I、Ⅱ、Ⅲ中溶液电极方程式分别为2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑、2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
I中生成0.01molOH-,c(OH-)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=13,
Ⅱ电解水,溶液呈中性,pH=7,
Ⅲ中生成0.01molH+,c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=1,
故选A.
点评 本题考查电解原理,侧重于学生的分析能力和计算能力的考查,为高考高频考点,难度中等,注意把握离子的放电顺序以及电解方程式的书写,为解答该题的关键.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
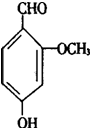 它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料,下列关于香兰素的判断不正确的是( )
它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料,下列关于香兰素的判断不正确的是( )| A. | 可与银氨溶液反应 | B. | 可与氢氧化钠溶液反应 | ||
| C. | 可与浓溴水发生取代反应 | D. | 分子中所有原子都在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
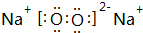 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与过量稀硫酸反应:OH-+Ba2++SO42-+H+=BaSO4↓+H2O | |
| B. | 碳酸氢钙与过量的NaOH 溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4OH-=AlO2-+2H2O | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
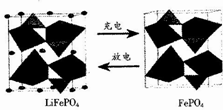 LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )| A. | 放电时该电极为负极 | |
| B. | 充电是Li+向阳极移动 | |
| C. | 充电时该电极发生氧化反应,反应式为LiFePO4-e-=FePO4+Li+ | |
| D. | 该电池可以用磷酸溶液作电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
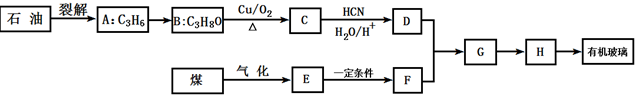
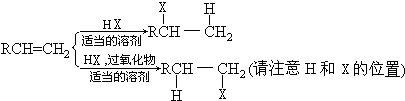
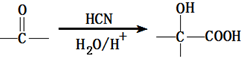
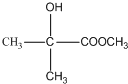 ;有机玻璃的链节是:
;有机玻璃的链节是: ;
;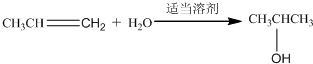 ;
;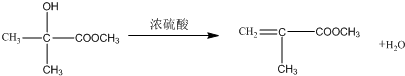 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com