
 ,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:| 催化剂 |
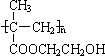 ,
,| 催化剂 |
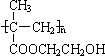 ;
;| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 水 |
| △ |
| 水 |
| △ |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
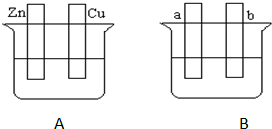
查看答案和解析>>
科目:高中化学 来源: 题型:
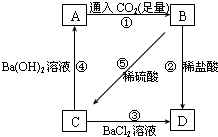 现有A、B、C、D四种溶液,在进行焰色反应时,火焰颜色都为黄色,它们之间转化关系如图所示.已知B为NaHCO3,请回答下列问题:
现有A、B、C、D四种溶液,在进行焰色反应时,火焰颜色都为黄色,它们之间转化关系如图所示.已知B为NaHCO3,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
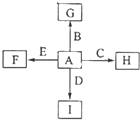 如图中,A为空气中常见的气体单质、B、C、E是金属单质,D为非金属单质.已知:①I是一种常见的温室气体,E原子核内有12个质子②G是一种红棕色固体粉末,反应C+G
如图中,A为空气中常见的气体单质、B、C、E是金属单质,D为非金属单质.已知:①I是一种常见的温室气体,E原子核内有12个质子②G是一种红棕色固体粉末,反应C+G| 高温 |
| 高温 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T/℃ | n(CO)/n(H2) | p/MPa | ||
| Ⅰ | 150 |
|
0.1 | ||
| Ⅱ | 5 | ||||
| Ⅲ | 300 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Na+、SO42-、Cl- |
| B、K+、Na+、NO3-、MnO4- |
| C、Na+、Ca2+、OH-、HCO3- |
| D、NH4+、Cu2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com