
【题目】用18.4molL﹣1的浓H2SO4配制100mL浓度为1molL﹣1的稀H2SO4,其操作可分为以下各步:
A.用量筒量取5.4ml浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注入容量瓶中;
C.将稀释后的H2SO4小心转移到100mL容量瓶里;
D.检查100mL容量瓶口部是否会发生滴漏;
E.加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平,试填空
①正确的操作顺序为(用字母填写)________________________.
②进行A步操作时,应选择下列量器___(填序号).
a.10ml量筒 b.50ml量筒 c.100ml量筒
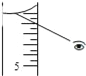
如果对装有浓H2SO4的量筒读数如下图所示,配制的稀H2SO4的浓度将__(偏高、偏低、无影响)
科目:高中化学 来源: 题型:
【题目】SO2、NO2能形成酸雨,某同学以它们为主题设计了两组实验:
【实验一】用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液(假设瓶内液体不扩散),C装置的集气瓶中还有气体剩余(可考虑液体的扩散) 。
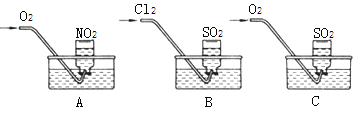
(1)写出装置A中总反应的化学方程式________________,假设该实验条件下,气体摩尔体积为a L/mol,则装置A的集气瓶中所得溶液溶质的物质的量浓度为______。
(2)写出B装置的溶液充满集气瓶时,有关反应的离子方程式__________________。
(3)实验前在C装置的水槽里滴加几滴紫色石蕊试液,通入氧气后,可观察到的实验现象是溶液颜色加深,写出反应的总化学方程式___________________________。
【实验二】利用上图B的原理,设计下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶D中溶液蓝色刚好消失时,立即关闭活塞K。
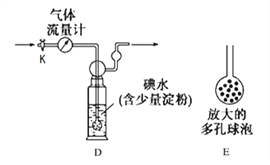
(4)D中导管末端连接一个多孔球泡E,其作用是________,可以提高实验的准确度。
(5)当流量计中刚好通过2L尾气时,D中溶液蓝色刚好消失,立即关闭活塞K,容器D中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为________g/L。若洗气瓶D中溶液蓝色消失后,没有及时关闭活塞K,测得的SO2含量________(填“偏高”、“偏低”或“无影响”)。
(6)硫的氢化物H2S气体燃烧也可能产生污染物SO2,试计算:标准状况下,0.35molH2S和11.2LO2在点燃条件下充分反应,所得氧化产物总质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极. 
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为极;
②电极b上发生的电极反应为;
③列式计算电极b上生成的气体在标准状况下的体积:
④电极c的质量变化是g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液;
乙溶液;
丙溶液;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:( )
Cu(OH)42—(深蓝色)。某同学进行下列实验:( )
下列说法不正确的是
A.①中出现蓝色沉淀
B.③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C.④中现象证明葡萄糖具有还原性
D.对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应 ![]() H2(g)+
H2(g)+ ![]() X2(g)HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
X2(g)HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5%
B.17%
C.25%
D.33%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象正确的是( )
A. 向 Ca(OH)2和 NaOH的混合溶液中通 入CO2
B. 向 FeCl3 溶液中加入锌粉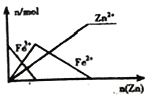
C. 向 NaOH 溶液中通入CO2
D. HCl与Cl2的混合气体通入NaOH溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在密闭容器中进行的工业合成氨的反应:N2+3H22NH3 , 下列说法错误的是 ( )
A.使用合适的催化剂可以增大反应速率
B.升高温度可以增大反应速率
C.增大压强不影响反应速率
D.增大N2浓度可以增大反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com